Birchova redukce
Birchova redukce je organická reakce využívaná v organické syntéze. Popsal ji roku 1944 australský chemik Arthur Birch při práci v laboratoři Dysona Perrinse na Oxfordské univerzitě[1][2][3][4][5][6] v návaznosti na dřívější práce Woostera a Godfreye zveřejněné roku 1937.[7]
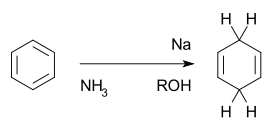
Tato reakce slouží k přeměně aromatických sloučenin na výsledné produkty (cyklohexa-1,4-dieny) s vodíkovými atomy připojenými na protější strany molekuly. Probíhá v kapalném amoniaku za přítomnosti sodíku, lithia nebo draslíku a alkoholu, například ethanolu nebo terc-butanolu. Je odlišná od katalytické hydrogenace, při níž vzniká cyklohexan.
V původní reakci popsané Arthurem Birchem byly použity sodík a ethanol. Alfred Wilds později zjistil, že při použití lithia se dojde k lepší výtěžnosti.[8] Rovněž se začal běžně používat terc-butanol.
 Birchova redukce
Birchova redukce
Dalším příkladem je redukce naftalenu:
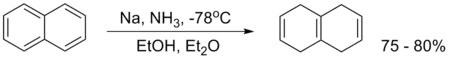 Birchova redukce naftalenu
Birchova redukce naftalenu
Bylo publikováno několik prací o této reakci.[9][10][11][12]
Základní reakční mechanismus
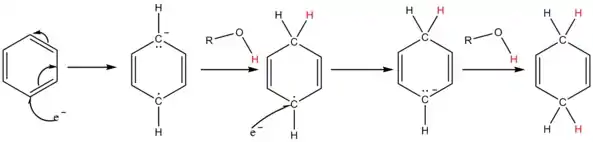
Roztok sodíku v kapalném amoniaku obsahuje elektridovou sůl [Na(NH3)x]+ e−, která má intenzivní modré zbarvení. K aromatickému kruhu jsou připojeny solvatované elektrony, které vytvářejí radikálový anion. Přidaný alkohol dodává radikálovému aniontu a také předposlednímu karbaniontu proton; pro většinu substrátů není amoniak dostatečně kyselý.
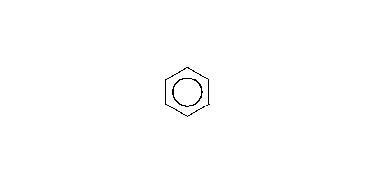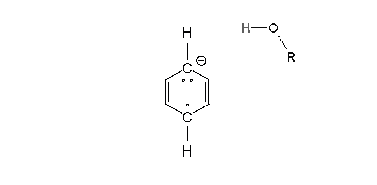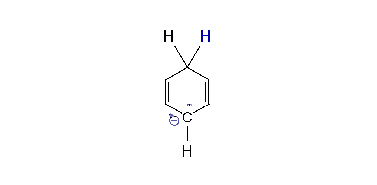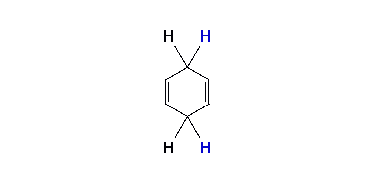
Regioselektivita reakce
Regioselektivita Birchovy redukce může být ovlivněna řadou způsobů (zmíněných níže). Birchovo pravidlo pro aromatické sloučeniny s donory elektronů jako jsou methoxylové či alkylové skupiny říká, že produkt bude mít dvojné vazby umístěné takovým způsobem, že na ně bude navázán maximální možný počet substituentů. U aromatických sloučenin se skupinami snižujícími elektronovou hustotu, jako je karboxyl, vzniknou dvojné vazby naopak tak, aby nenesly žádné substituenty. V obou případech nejsou tyto zbylé dvojné vazby konjugované.
Regioselektivitu Birchovy redukce lze ovlivnit zejména těmito způsoby:
- V kapalném amoniaku se alkalické kovy rozpouštějí za vzniku modrého roztoku, o němž se zjednodušeně předpokládá, že má „volné elektrony“. Tyto elektrony jsou aromatickým kruhem postupně absorbovány. Jakmile je absorbován první elektron, vzniká radikálový anion. Následně molekula alkoholu uvolní hydroxylový vodík a vytvoří se nová vazba uhlík-vodík, čímž vznikne radikál. Následně je absorbován druhý elektron za tvorby karbaniontu cyklohexadienylového typu (tedy C=C-C-C=C v šestičlenném cyklu se záporným nábojem). Následně je tento cyklohexadienylový anion protonován za přítomnosti alkoholu. K protonaci dochází ve středu cyklohexadienylového systému. Takováto regioselektivita je charakteristická.
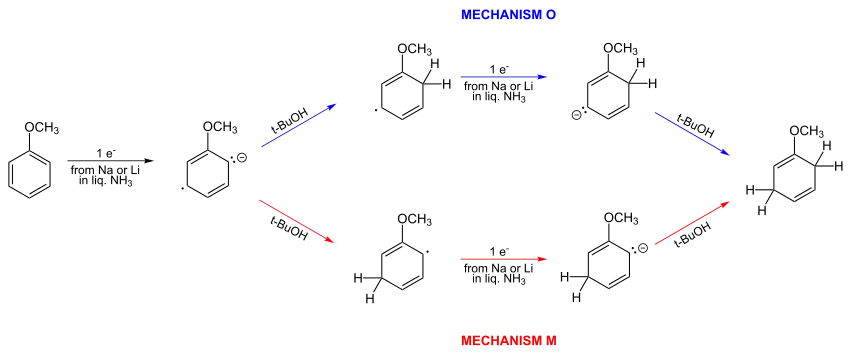
- Na strukturu produktu má vliv místo, kde byl radikálový anion protonován. Při použití elektronových donorů jako jsou methoxyskupina (MeO) a alkylové skupiny, dojde podle některých výzkumníků k orto (tedy 1,2) protonaci. Podle jiných (i samotného Arthura Birche) proběhne meta (1,3) protonace.
U substituentů „odtahujících“ elektrony se předpokládá para (1,4) protonace. Podle Birchových empirických pravidel by se v případě elektronových donorů měl vytvořit produkt s nejvyšším možným počtem substituentů na místech, kde vzniknou výsledné dvojné vazby. Substituenty „odtahující“ elektrony by se měly připojit na uhlíkové atomy, ze kterých nevycházejí dvojné vazby.
- Součástí reakčního mechanismu jsou různé detaily molekulárních změn. U donorových skupin předpokládal Birch, že upřednostňování polohy meta je způsobeno kvalitativními důvody, což však nebylo experimentálně ověřeno.
- V roce 1961 bylo jednoduchým výpočtem elektronové hustoty zjištěno, že největší záporný náboj, a tedy i pravděpodobnost protonace, je v pozici ortho. Další protonace by měla probíhat ve středu cyklohexadienylového aniontu, za vzniku nekonjugovaného produktu.
Mechanismus
Mechanismus Birchovy redukce byl předmětem mnoha diskusí. Původně se předpokládalo, že u methoxy- a alkylových skupin dochází k protonaci radikálového aniontu. Později bylo navrhnuto, že poslední krok, protonace cyklohexadienylového aniontu, probíhá v ortho-pozici vzhledem k substituentům. Původní Birchův mechanismus byl založen na kvalitativním uvažování o elektronové hustotě radikálového aniontu.[1]
V roce 1961 bylo Hückelovou metodou spočítáno, že Birchem navržený mechanismus nebyl správný. Ze dvou možných mechanismů, zobrazených níže, je správný mechanismus O.[13][14]
Birchova redukce se substituenty „odtahujícími“ elektrony
Na rozdíl od variant se substituenty dodávajícími elektrony jsou varianty Birchovy redukce se substituenty „odtahujícími“ elektrony přehlednější. Dianion D je zachycován alkylhalogenidy.
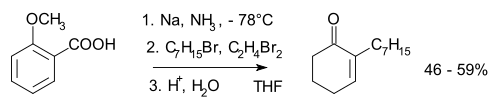
Níže je zobrazen mechanismus redukce kyseliny benzoové se zahrnutím případné alkylace:
Tento dianion vzniká nezávisle na tom, zda je při redukci použit alkohol. Počáteční protonace t-butanolem probíhá většinou do polohy para.[15][16]
Birchova alkylace
Za přítomnosti alkylhalogenidu může u karbaniontu také dojít k nukleofilní substituci za tvorby vazby uhlík-uhlík. U substituovaných aromatických sloučenin se substituenty „odtahujícími“ elektrony, jako jsou karboxylové kyseliny, dochází ke stabilizaci a vzniku nejméně substituovaného alkenu. U skupin poskytujících elektrony dochází k opačnému procesu. Mezi produkty převládá méně termodynamicky stabilní nekonjugovaný 1,4-adukt nad stabilnějším 1,3-dienem, protože největší orbitalový koeficient nejvyššího obsazeného MO konjugovaného pentadienylového aniontového meziproduktu je na centrálním atomu uhlíku. Jakmile vznikne, tak se cyklohexa-1,4-dien nemůže dostat do rovnováhy s termodynamicky stabilnějším produktem; vzniká tak pozorovaný kinetický produkt. U Birchovy alkylace je anion vzniklý při Birchově redukci zachycen vhodným elektrofilem, například halogenalkanem:
Při níže zobrazené reakci dochází k připojení 1,4-dibrombutanu na t-butylbenzoát za vzniku alkylovaného cyklohexa-1,4-dienu jako produktu:[17]
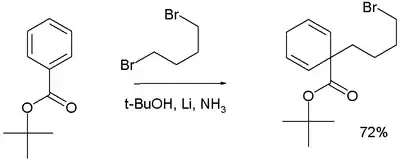 Birchova alkylace
Birchova alkylace
Modifikace
Jelikož je amoniak kondenzován do baňky a po dokončení reakce se odpařuje, tak může být celý proces problematický a časově náročný. Lze ovšem použít i jiná rozpouštědla, jako například tetrahydrofuran (THF)[18][19] nebo směs n-propylaminu s ethylendiaminem,[20] v obou případech s podobnými výsledky. Druhý z těchto postupů je ve skutečnosti modifikací Benkeserovy reakce, kterou se v její původní podobě redukuje naftalen na oktahydro- a dekahydronaftalen.
 Modifikovaná Benkeserova redukce
Modifikovaná Benkeserova redukce
Při takovéto redukce naftalenu na isotetralin (1,4,5,8-tetrahydronaftalen) vzniká rovněž tetralin (1,2,3,4-tetrahydronaftalen) jako vedlejší produkt, podobně jako u pravé Birchovy redukce.
Odkazy
Související články
- Benkeserova reakce
- Solvatovaný elektron
Externí odkazy
 Obrázky, zvuky či videa k tématu Birchova redukce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Birchova redukce na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Birch reduction na anglické Wikipedii.
- Birch, A. J. Reduction by dissolving metals. Part I. J. Chem. Soc.. 1944, s. 430. DOI 10.1039/JR9440000430. (anglicky)
- Birch, A. J. Reduction by dissolving metals. Part II. J. Chem. Soc.. 1945, s. 809. DOI 10.1039/jr9450000809. (anglicky)
- Birch, A. J. Reduction by dissolving metals. Part III. J. Chem. Soc.. 1946, s. 593. DOI 10.1039/jr9460000593. (anglicky)
- Birch, A. J. Reduction by dissolving metals. Part IV. J. Chem. Soc.. 1947, s. 102. DOI 10.1039/jr9470000102. (anglicky)
- Birch, Arthur J. Reduction by dissolving metals. Part V. J. Chem. Soc.. 1947, s. 1642. DOI 10.1039/jr9470001642. (anglicky)
- Birch, A. J.; MUKHERJI, S. M. Reduction by dissolving metals. Part VI. Some applications in synthesis. J. Chem. Soc.. 1949, s. 2531. DOI 10.1039/jr9490002531. (anglicky)
- WOOSTER, C. B.; GODFREY, K. L. Mechanism of the Reduction of Unsaturated Compounds with Alkali Metals and Water. Journal of the American Chemical Society. 1937, s. 596. DOI 10.1021/ja01282a504. (anglicky)
- Wilds, A. L.; NELSON, N. A. A Superior Method for Reducing Phenol Ethers to Dihydro Derivatives and Unsaturated Ketones. J. Am. Chem. Soc.. 1953, s. 5360–5365. DOI 10.1021/ja01117a064. (anglicky)
- Birch, A. J.; SMITH, H. Reduction by metal–amine solutions: applications in synthesis and determination of structure. Quart. Rev.. 1958, s. 17. DOI 10.1039/qr9581200017. (anglicky)
- Caine, D. Reduction and Related Reactions of α,β-Unsaturated Carbonyl Compounds with Metals in Liquid Ammonia. Org. React.. 1976, s. 1–258. ISBN 0471264180. DOI 10.1002/0471264180.or023.01. (anglicky)
- Rabideau, P. W.; MARCINOW, Z. The Birch Reduction of Aromatic Compounds. Org. React.. 1992, s. 1–334. ISBN 0471264180. DOI 10.1002/0471264180.or042.01. (anglicky)
- Mander, L. N. Partial Reduction of Aromatic Rings by Dissolving Metals and by Other Methods. Comp. Org. Syn.. 1991, s. 489–521. ISBN 978-0-08-052349-1. DOI 10.1016/B978-0-08-052349-1.00237-7. (anglicky)
- Zimmerman, H. E. Orientation in Metal Ammonia Reductions. Tetrahedron. 1961, s. 169–176. DOI 10.1016/0040-4020(61)80067-7. (anglicky)
- "Base-Catalyzed Rearrangements," Chapter 6 of "Molecular Rearrangements," Zimmerman, H. E., Ed. P. DeMayo, Interscience, 345–406, New York, 1963.
- Bachi, J. W.; EPSTEIN, Y.; HERZBERG-MINZLY, H.; LOEWNENTHAL, J. E. Synthesis of compounds related to gibberellic acid. III. Analogs of ring a of the gibberellins. J. Org. Chem.. 1969, s. 126–135. DOI 10.1021/jo00838a030. (anglicky)
- Guo, Z.; SCHULTZ, A. G. Organic synthesis methodology. Preparation and diastereoselective birch reduction-alkylation of 3-substituted 2-methyl-2,3-dihydroisoindol-1-ones. J. Org. Chem.. 2001, s. 2154–2157. DOI 10.1021/jo005693g. PMID 11300915. (anglicky)
- Clive, Derrick L. J.; SUNASEE, RAJESH. Formation of Benzo-Fused Carbocycles by Formal Radical Cyclization onto an Aromatic Ring. Organic Letters. 2007, s. 2677–2680. DOI 10.1021/ol070849l. PMID 17559217. (anglicky)
- Ecsery, Zoltan; MULLER, MIKLOS. Reduction vitamin D2 with alkaly metals. Magyar kémiai folyóirat. 1961, s. 330–332. (anglicky)
- Donohoe, Timothy J.; HOUSE, DAVID. Ammonia Free Partial Reduction of Aromatic Compounds Using Lithium Di-tert-butylbiphenyl (LiDBB). Journal of Organic Chemistry. 2002, s. 5015–5018. DOI 10.1021/jo0257593. PMID 12098328. (anglicky)
- Garst, Michael E.; LLOYD J.; SHERVIN; N. ANDREW; NATALIE C.; ALFRED A. Reductions with Lithium in Low Molecular Weight Amines and Ethylenediamine. Journal of Organic Chemistry. 2000, s. 7098–7104. DOI 10.1021/jo0008136. PMID 11031034. (anglicky)