Tetrakarbonylželeznatan disodný
Tetrakarbonylželeznatan disodný je organická sloučenina se vzorcem Na2[Fe(CO)4]. Používá se jako roztok, například v tetrahydrofuranu nebo dimethoxyethanu, rozpouštědlech, která se vážou na sodný kation.[1]
| Tetrakarbonylželeznatan disodný | |
|---|---|
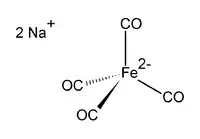
Strukturní vzorec | |
| Obecné | |
| Systematický název | tetrakarbonylželeznatan disodný |
| Funkční vzorec | Fe(CO)4Na2 |
| Sumární vzorec | FeC4O4Na2 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 14878-31-0 |
| EC-no (EINECS/ELINCS/NLP) | 238-951-0 |
| PubChem | 73357794 |
| SMILES | [CH-]=O.[CH-]=O.[CH-]=O.[CH-]=O.[Na+].[Na+].[Fe+2] |
| InChI | 1S/4CHO.Fe.2Na/c4*1-2;;;/h4*1H;;;/q4*-1;+2;2*+1 |
| Vlastnosti | |
| Molární hmotnost | 213,86 g/mol |
| Hustota | 2,16 g/cm3 |
| Rozpustnost ve vodě | rozkládá se |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v tetrahydrofuranu, dioxanu a dimethylformamidu |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Tato látka, citlivá na přítomnost kyslíku, se používá ve výzkumu v organokovové a organické chemii. Její roztok v dioxanu se nazývá Collmanovo činidlo, podle Jamese P. Collmana, který zavedl její používání.[2]
Struktura
Dianion [Fe(CO)4]2− je izoelektronický s Ni(CO)4.[3][4]
Fe centrum je tetraedrické a vyskytují se u něj Na+---OCFe interakce. V dioxanových roztocích tvoří rozpouštědlo komplex se sodným kationtem.
Příprava
Tetrakarbonylželeznatan disodný se původně připravoval na místě reakcí pentakarbonylu železa se sodným amalgámem.[5]
Novější postupy využívají jako redukční činidla ketyly naftalenidu nebo benzofenonidu sodného:[1][6]
- Fe(CO)5 + 2 Na → Na2[Fe(CO)4] + CO
Při použití menšího množství sodíku vzniká tmavě žlutý diželeznan oktakarbonylu:[1]
- 2 Fe(CO)5 + 2 Na → Na2[Fe2(CO)8] + 2 CO
Existují i jiné postupy nevyužívající pentakarbonyl železa.[7]
Reakce a použití
Tetrakarbonylželeznatan disodný se používá na přípravu aldehydů z alkylhalogenidů.[8]
Původně se tato látka využívala k dvoukrokovému převádění primárních alkylbromidů na odpovídající aldehydy:[5]
- Na2[Fe(CO)4] + RBr → Na[RFe(CO)4] + NaBr
Tento roztok poté reagoval s trifenylfosfinem a kyselinou octovou na aldehyd, RCHO.
I z acylchloridů lze pomocí tetrakarbonylželeznatanu disodného získat aldehydy; tato reakce probíhá přes acylový komplex železa.
- Na2[Fe(CO)4] + RCOCl → Na[RC(O)Fe(CO)4] + NaCl
- Na[RC(O)Fe(CO)4] + HCl → RCHO + "Fe(CO)4" + NaCl
Tetrakarbonylželeznatan disodný reaguje s alkylhalognidy (RX) za vzniku alkylových komplexu:
- Na2[Fe(CO)4] + RX → Na[RFe(CO)4] + NaX
Tyto alkyly lze přeměnit na karboxylové kyseliny a acylhalogenidy:
- Na[RFe(CO)4] + O2, H+ →→ RCO2H + Fe...
- Na[RFe(CO)4] + 2 X2 → RC(O)X + FeX2 + 3 CO + NaX
Lithium (nebo CO) může vytvořit komplex [LFe(CO)3(C(O)R)]Na, na nějž lze navázat R'X za vzniku RC(O)R'.
- Na[RFe(CO)4] + L → [LFe(CO)3(C(O)R)]Na → RC(O)R' + [LFe(CO)3]Na
Reference
V tomto článku byl použit překlad textu z článku Disodium tetracarbonylferrate na anglické Wikipedii.
- H. Strong; P. J. Krusic; J. San Filippo. Sodium Carbonyl Ferrates, Na2[Fe(CO)4], Na2[Fe2(CO)8], and Na2[Fe3(CO)11]. Bis[μ-Nitrido-Bis(triphenylphosphorus)1+] Undeca-Carbonyltriferrate2−, [(Ph3P)2N]2[Fe3(CO)11]. Inorganic Syntheses. 1990, s. 203–207. ISBN 0-471-52619-3. DOI 10.1002/9780470132593.ch52.
- G. L. Miessler; D. A. Tarr. Inorganic Chemistry. Upper Saddle River, NJ: Pearson, 2004. Dostupné online.
- H. B. Chin; R. Bau. The Crystal Structure of Disodium Tetracarbonylferrate. Distortion of the Tetracarbonylferrate2− Anion in the Solid State. Journal of the American Chemical Society. 1976, s. 2434–2439. DOI 10.1021/ja00425a009.
- R. G. Teller; R. G. Finke; J. P. Collman; H. B. Chin; R. Bau. Dependence of the tetracarbonylferrate(2-) geometry on counterion: crystal structures of dipotassium tetracarbonylferrate and bis(sodium crypt) tetracarbonylferrate [crypt = N(CH2CH2OCH2CH2OCH2CH2)3N]. Journal of the American Chemical Society. 1977, s. 1104–1111. DOI 10.1021/ja00446a022.
- M. P. Cooke. Facile Conversion of Alkyl Bromides into Aldehydes Using Sodium Tetracarbonylferrate(-II). Journal of the American Chemical Society. 1970, s. 6080–6082. DOI 10.1021/ja00723a056.
- Richard G. Finke; Thomas N. Sorrell. Nucleophilic Acylation with Disodium Tetracarbonylferrate: Methyl 7-Oxoheptanoate and Methyl 7-Oxoöctanoate. Organic Syntheses. 1979, s. 102. DOI 10.15227/orgsyn.059.0102.
- M. Scholsser. Organometallics in Synthesis, Third Manual. Chicester, England: Wiley, 2013.
- R. D. Pike. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2001. DOI 10.1002/047084289X.rd465. Kapitola Disodium Tetracarbonylferrate(-II).