Chlorid hlinitý
Chlorid hlinitý (AlCl3) je sloučenina hliníku a chloru. Jedná se o pevnou látku s nízkým bodem tání a varu, atomy v molekule jsou vázány kovalentně. Při teplotě 178 °C sublimuje. Roztavený AlCl3 je špatným vodičem elektřiny,[2] na rozdíl od iontově vázaných halogenidů, jako je například chlorid sodný.
| Chlorid hlinitý | |
|---|---|

Prášková forma | |

Krystalická forma | |
| Obecné | |
| Systematický název | Chlorid hlinitý |
| Anglický název | Aluminium chloride |
| Německý název | Aluminiumchlorid |
| Sumární vzorec | AlCl3 AlCl3•6H2O (hexahydrát) |
| Vzhled | Bezvodý bílý, hydratovaný nažloutlý až žlutý |
| Identifikace | |
| Registrační číslo CAS | 7446-70-0 |
| 10124-27-3 (hexahydrát) | |
| EC-no (EINECS/ELINCS/NLP) | 231-208-1 |
| Indexové číslo | 013-003-00-7 |
| PubChem | 24012 |
| Vlastnosti | |
| Molární hmotnost | 133,34 g/mol 241,432 g/mol (hexahydrát) |
| Teplota tání | 192,6 °C (229 kPa) |
| Teplota sublimace | 178,4 °C |
| Teplota rozkladu | 100 °C (hexahydrát) |
| Hustota | 2,456 g/cm3 (17 °C) 2,44 g/cm3 (20 °C) 1,664 g/cm3 (20 °C, hexahydrát) |
| Dynamický viskozitní koeficient | 0,35 cP (197 °C) 0,26 cP (237 °C) 0,20 cP (277 °C) |
| Rozpustnost ve vodě | 44,9 g/100 g (0 °C) 46,3 g/100 g (25 °C) 47 g/100 g (30 °C) 46,5 g/100 g (60 °C) Hexahydrát 123,4 g/100 g (0 °C, hexahydrát) 131,9 g/100 g (20 °C, hexahydrát) 147,2 g/100 g (100 °C, hexahydrát) |
| Rozpustnost v polárních rozpouštědlech |
Ethanol 100 g/100 g (12,5 °C) |
| Rozpustnost v nepolárních rozpouštědlech |
Trichlormethan 0,72 g/100 g (25 °C) |
| Povrchové napětí | 9,12 mN/m (200 °C) 6,30 mN/m (240 °C) 3,49 mN/m (280 °C) 1,38 mN/m (310 °C) |
| Struktura | |
| Krystalová struktura | šesterečná klencová (hexahydrát) |
| Hrana krystalové mřížky | a= 347,5 pm c= 851,4 pm hexahydrát Poměr a : c = 1 : 0,535 6 α= 111° 40´ |
| Tvar molekuly | trigonálně rovinný (monomer, plyn) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −704,2 kJ/mol |
| Standardní molární entropie S° | 109,3 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −628,6 kJ/mol |
| Izobarické měrné teplo cp | 0,683 JK−1g−1 1,315 JK−1g−1 (hexahydrát) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H314 |
| R-věty | R34 |
| S-věty | S1/2, S7/8, S28, S45 |
| Teplota vznícení | není vznětlivý |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura
V pevné fázi se AlCl3 vyskytuje v podobě šesterečných krystalů.
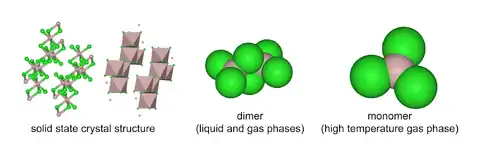
AlCl3 má strukturu „YCl3“ s krychlovou těsně zaplněnou vrstvenou krystalovou strukturou Al3+.[3] AlBr3 má naproti tomu strukturu více molekulární, kde centra Al3+ obsazují přilehlé čtyřstěnné díry těsně zaplněné mříže iontů Br−. Při tání AlCl3 vzniká dimer Al2Cl6, který se může vypařovat. Při vyšších teplotách tento dimer disociuje do trojúhelníkových planárních molekul AlCl3, strukturálně analogických fluoridu boritému BF3.
Chlorid hlinitý je silně hygroskopický a při náhlém kontaktu s vodou může vzhledem ke značnému vývinu tepla při hydrataci explodovat. Vodné roztoky AlCl3 jsou iontové a vedou tedy dobře elektrický proud. Tyto roztoky jsou kyselé, což indikuje částečnou hydrolýzu iontu Al3+. Reakci lze zjednodušeně popsat takto:
- [Al(H2O)6]3+ + H2O ⇌ [Al(OH)(H2O)5]2+ + H3O+
AlCl3 je pravděpodobně nejčastěji používanou Lewisovou kyselinou a též jednou z nejsilnějších. Nachází široké uplatnění v chemickém průmyslu jako klasický katalyzátor pro Friedel-Craftsovy reakce, jak acylační, tak alkylační. Používá se též při polymerizacích a izomerizacích uhlovodíků. Hliník tvoří s chlorem kromě AlCl3 ještě chlorid hlinný (AlCl), ten je však velmi nestabilní a je znám pouze v plynné fázi.[2]
Fyzikálně-chemické vlastnosti
Chlorid hlinitý se poměrně dobře rozpouští ve vodě, o poznání lépe se ale rozpouští jeho hexahydrát. Rozpouští se také dobře i v jiných polárních rozpouštědlech jako jsou methanol (CH3OH), ethanol (CH3CH2OH) a aceton (CH3COCH3), ale také i v nepolárních rozpouštědlech jako je trichlormethan (CHCl3), tetrachlormethan (CCl4) nebo diethylether (CH3CH2OCH2CH3).
Chlorid hlinitý je silnou Lewisovou kyselinou, schopnou tvořit stabilní Lewisovy acidobazické adiční sloučeniny i se slabými Lewisovými zásadami jako jsou benzofenon a mesitylen.[4] Není překvapivé, že za přítomnosti chloridových iontů tvoří ionty AlCl4−.
Ve vodě vzniká částečnou hydrolýzou chlorovodík nebo kationtu H3O+, jak je popsáno výše. Vodné roztoky se chovají podobně jako u jiných solí hliníku obsahujících hydratované ionty Al3+, kdy vzniká gelovitá sraženina hydroxidu hlinitého reakcí s odpovídajícím množstvím hydroxidu sodného:
- AlCl3(|aq) + 3 NaOH(aq) → Al(OH)3(s) + 3NaCl(aq)
Příprava
Chlorid hlinitý se ve velké míře vyrábí exotermní reakcí kovového hliníku s chlorem nebo chlorovodíkem při teplotách 650 až 750 °C:[2]
- 2 Al + 3 Cl2 → 2 AlCl3
- 2 Al + 6 HCl → 2 AlCl3 + 3 H2
Hydratované formy se připravují rozpouštění oxidů hliníku v suché kyselině chlorovodíkové při 150 °C.
Při přípravě v laboratoři musí být reakce prováděna velice opatrně, protože hliník je při této reakci zrádný: díky vrstvičce oxidu hlinitého zprvu vypadá, že reaguje velice pomalu, ale do cca 15 sekund začne rychlost stoupat, a po jedné minutě je již skoro v maximu. Pokud chemik myslíce si, že rychlost reakce je stejná, jako krátce po vhození hliníku do kyseliny, neustále přihazuje kousky hliníku, může dojít ke značným komplikacím, neboť se roztok zahřívá, zvyšuje se teplota a tím pádem i rychlost reakce, což může skončit zahřátím roztoku na teplotu varu a uvolňováním nebezpečného chlorovodíku.
Použití
Chlorid hlinitý, častěji však hexahydrát chloridu hlinitého, je hlavní součástí (obsah do 20 %) přípravků proti pocení na trhu. Ve vědeckých kruzích se vede široká debata o škodlivosti hlinitých solí na lidský organismus, dosud se nepodařila přímá škodlivost prokázat.
Bezpečnost
Bezvodý AlCl3 bouřlivě reaguje s vodou a se zásadami, proto je třeba náležitá opatrnost. Hydratované soli jsou méně problematické.
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Reference
V tomto článku byl použit překlad textu z článku Aluminium chloride na anglické Wikipedii.
- Aluminum chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, Oxford, United Kingdom, 1984.
- A. F. Wells, Structural Inorganic Chemistry, Oxford Press, Oxford, United Kingdom, 1984.
- G. A. Olah (ed.), Friedel-Crafts and Related Reactions, Vol. 1, Interscience, New York, 1963.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid hlinitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid hlinitý na Wikimedia Commons  Encyklopedické heslo Aluminiumchlorid v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Aluminiumchlorid v Ottově slovníku naučném ve Wikizdrojích- Aluminum Chloride Information
- International Chemical Safety Card 1125
- Index of Organic Synthesis procedures that utilize AlCl3
- The period 3 chlorides
- MSDS
