Cyklooktatetraen
Cyklooktatetraen nebo cyklookta-1,3,5,7-tetraen (COT) je nenasycený cyklický uhlovodík se vzorcem C8H8; za pokojové teploty bezbarvá až nažloutlá kapalina. Vzhledem ke své stechiometrické podobnosti s benzenem se stal předmětem výzkumu i řady sporů.
| Cyklooktatetraen | |
|---|---|

Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | cyklookta-1,3,5,7-tetraen |
| Ostatní názvy | [8]annulen |
| Sumární vzorec | C8H8 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 629-20-9 |
| EC-no (EINECS/ELINCS/NLP) | 211-080-3 |
| PubChem | 637866 |
| SMILES | C1=CC=CC=CC=C1 |
| InChI | 1S/C8H8/c1-2-4-6-8-7-5-3-1/h1-8H/b2-1-,3-1?,4-2?,5-3-,6-4-,7-5?,8-6?,8-7- |
| Vlastnosti | |
| Molární hmotnost | 104,158 g/mol |
| Teplota tání | −4,7 °C (268,4 K)[1] |
| Teplota varu | 140,5 °C (413,6 K)[1] |
| Hustota | 0,925 g/cm3 |
| Rozpustnost ve vodě | nemísitelný |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H304 H315 H319 H335[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264 P271 P280 P301+310 P302+352 P303+361+353 P304+340 P305+351+338 P312 P321 P331 P332+313 P337+313 P361 P362 P370+378 P403+233 P403+235 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Na rozdíl od benzenu cyklooktatetraen není aromatický; tuto vlastnost však má jeho dianion, C8H 2-
8 (nazývaný cyklooktatetraenid). Reaktivita tohoto uhlovodíku odpovídá běžným polyenům, například se účastní adičních reakcí; u benzenu jsou oproti tomu běžné substituční reakce.
Historie
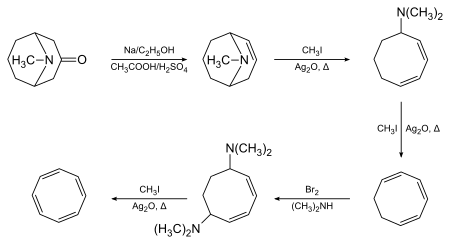
Cyklooktatetraen-1,3,5,7-tetraen poprvé připravil Richard Willstätter v roce 1905 Hofmannovou eliminací pseudopelletierinu:[2][3]
Willstätter zjistil, že se u vzniklé sloučeniny neobjevuje očekávaná aromaticita. Mezi roky 1939 a 1943 se několik chemiků neúspěšně pokusilo o její přípravu; zjistilo se, že vytvořili izomerní styren. Během 2. světové války Walter Reppe vyvinul jednokrokovou jednoduchou syntézu cyklooktatetraenu z acetylenu, tedy stejného materiálu, jaký použil Willstätter.[4]
Pochyby o přesnosti Willstätterovy syntézy byly zažehnány, když ji Arthur C. Cope se svými spolupracovníky roku 1947 plně zopakoval s použitím původních postupů. Získal stejný cyklooktatetraen[5] a provedl spektrální analýzy řady meziproduktů, čímž přesnost Willstätterova postupu dále potvrdil.[6]
Struktura
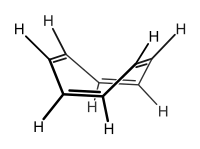
Už při prvních studiích se ukázalo, že reaktivita cyklooktatetraenu neodpovídá chemii aromatických sloučenin.[7]
Následně experimenty založené na elektronové difrakci ukázaly, že délky všech vazeb C-C jsou stejné.[8]
Data z rentgenové difrakce, která poskytl H. S. Kaufman, ovšem ukázala, že cyklooktatetraen zaujímá několik konformací a má dvě různé délky vazeb C–C.[9]
Zjistilo se tak, že jde o anulen, ve kterém se střídají jednoduché a dvojné vazby mezi atomy uhlíku.
V základním stavu nejde o rovinnou molekulu; úhel C=C−C je 126,1° a C=C−H činí 117,6°.[10] Bodová grupa cyklooktatetraenu je D2d.[11]
Z rovinných přechodných stavů je D4h v důsledku Jahnova–Tellerova efektu stabilnější než D8h.[12]
Příprava
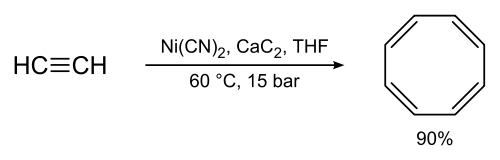
Původní Willstätterova syntéza (posloupnost čtyř eliminačních reakcí na cyklooktanu) má nízkou výtěžnost Reppeova symtéza z acetylenu za vysokého tlaku a přítomnosti horké směsi kyanidu nikelnatého a karbidu vápenatého, se vyznačuje výrazně lepší výtěžností, okolo 90 %:[4]
Další možností je fotolýza barrelenu, jenž je s cyklooktatetraenem strukturně izomerní, meziproduktem je přitom další izolovatelný izomer, semibulvalen.[13]
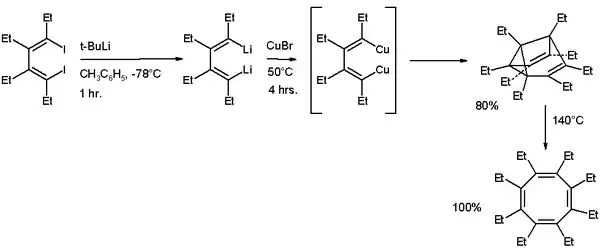
Deriváty cyklooktatetraenu je rovněž možné získat skrz semibulvalenové meziprodukty. V níže zobrazené posloupnosti reakcí se vytváří oktaethylcyklooktatetraen (C8Et8) tepelnou izomerizací oktaethylsemibulvalenu, jenž vzniká cyklodimerizací 1,2,3,4-tetraethyl-1,4-dilithio-buta-1,3-dienu za přítomnosti bromidu měďného.[14]
Protože je cyklooktatetraen nestálý a snadno vytváří výbušné organické peroxidy, tak se do komerčních vzorků obvykle přidávají malá množství hydrochinonu. Opakovaně otevírané lahve mohou kolem hrdla mít bílé krystalky peroxidu, které mohou v důsledku mechanického působení vybouchnout.
Výskyt
Cyklooktatetraen byl izolován z některých hub.[15]
Reakce
Vazby π v COT reagují podobně jako u alkenů. Reakcemi COT s peroxykyselinami nebo dimethyldioxiranem vznikají epoxidy; známo je také mnoho dalších adicí. Polymerizací s otvíráním kruhu z cyklooktatetraenu lze získat polyacetylen.[16]
COT i jeho analogy s postranními řetězci je možné použít na přípravu ligandů a sendvičových sloučenin.
Cyklooktatetraen též vstupuje do přesmykových reakcí, jimiž vznikají areny, například oxidací vodným roztokem síranu rtuťnatého vzniká fenylacetaldehyd[4][17] a fotochemickým přesmykem monoepoxidu COT se vytváří benzofuran.[18]
Cyklooktatetraenid jako ligand a prekurzor ligandů
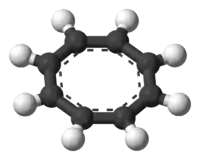
COT snadno reaguje s draslíkem za vzniku soli K2COT, obsahující dianion C8H 2−
8 .[19]
Dianion je rovinný, osmistěnný a s 10 π elektrony také aromatický.
Cyklooktatetraen vytváří komplexy s některými kovy, jako jsou yttrium, lanthanoidy a aktinoidy.[20] Uranocen, (U(COT)2), obsahuje dva ῃ8-COT ligandy. U bis(cyklooktatetraen)železa (Fe(COT)2) je jeden COT ῃ6 a druhý ῃ4. Trikarbonyl (cyklooktatetraen)železa obsahuje ῃ4-COT. 1H-NMR spektra těchto komplexů ukazují, že jsou singletové.[21]

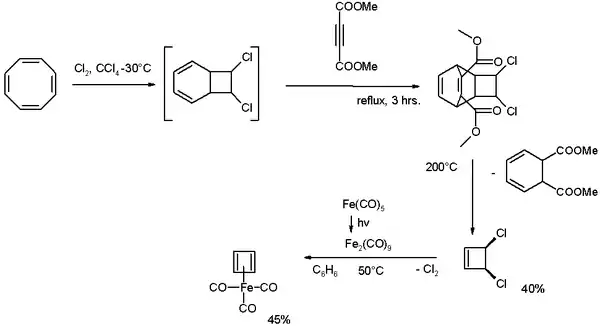
Cyklooktatetraen lze chlorovat za vzniku [4.2.0]-bicyklické sloučeniny, která dále vstupuje do Dielsovy–Alderovy reakce s dimethylacetylendikarboxylátem. Poté se může retro-Dielsovou–Alderovou reakcí při 200 °Cuvolnit cis-dichlorcyklobuten.
Cyklooktatetraen také reaguje s nonakarbonylem diželeza na trikarbonyl (cyklobutadien)železa.[22][23]
Odkazy
Související články
- Cyklobutadien
- Pentalen
- Barrelen, strukturní izomer cyklooktatetraenu
- Heptafulven, strukturní izomer cyklooktatetraenu
- Semibulvalen
- Benzen
Reference
V tomto článku byl použit překlad textu z článku Cyclooctatetraene na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/637866
- S. Mason. The Science and Humanism of Linus Pauling (1901−1994). Chemical Society Reviews. 1997, s. 29–39. DOI 10.1039/CS9972600029.
- Richard Willstätter; Ernst Waser. Über Cyclo-octatetraen. Berichte der Deutschen Chemischen Gesellschaft. 1911, s. 3423–3445. Dostupné online. DOI 10.1002/cber.191104403216.
- Walter Reppe; Otto Schlichting; Karl Klager; Tim Toepel. Cyclisierende Polymerisation von Acetylen. I. Über Cyclooctatetraen. Justus Liebigs Annalen der Chemie. 1948, s. 1–92. DOI 10.1002/jlac.19485600102.
- Arthur C. Cope; C. G. Overberger. The synthesis of cycloöctatetraene from pseudopelletierine. Journal of the American Chemical Society. 1947, s. 976. DOI 10.1021/ja01196a513. PMID 20292490.
- Arthur C. Cope; C. G. Overberger. Cyclic Polyolefins. I. Synthesis of Cyclooctatetraene from Pseudopelletierine. Journal of the American Chemical Society. 1947, s. 1433–1437. DOI 10.1021/ja01184a041. PMID 18915758.
- A. W. Johnson. Organic Chemistry. Science Progress. 1947, s. 506–515.
- O. Bastiensen; O. Hassel; A. Langseth. The 'Octa-Benzene', Cyclo-octatetraene (C8H8). Nature. 1947, s. 128. DOI 10.1038/160128a0. Bibcode 1947Natur.160..128B.
- H. S. Kaufman; I. Fankuchen; H. Mark. Structure of Cyclo-octatetraene. Nature. 1948, s. 165. DOI 10.1038/161165a0. Bibcode 1948Natur.161..165K.
- P. M. Thomas; A. Weber. High resolution Raman spectroscopy of gases with laser sources. XIII – the pure rotational spectra of 1,3,5,7-cyclooctatetraene and 1,5-cyclooctadiene. Journal of Raman Spectroscopy. 1978, s. 353–357. DOI 10.1002/jrs.1250070614. Bibcode 1978JRSp....7..353T.
- K. H. Claus; C. Krüger. Structure of cyclooctatetraene at 129 K. Acta Crystallographica C. 1988-09-15, s. 1632–1634. DOI 10.1107/S0108270188005840.
- Tohru Nishinaga; Takeshi Ohmae; Masahiko Iyoda. Recent Studies on the Aromaticity and Antiaromaticity of Planar Cyclooctatetraene. Symmetry. 2010-02-05, s. 76–97. DOI 10.3390/sym2010076. Bibcode 2010Symm....2...76N.
- H. E. Zimmerman; G. L. Grunewald. The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene. Journal of the American Chemical Society. 1966, s. 183–184. Dostupné online. DOI 10.1021/ja00953a045.
- C. Wang; J. Yuan; G. Li; Z. Wang; S. Zhang; Z. Xi. Metal-Mediated Efficient Synthesis, Structural Characterization, and Skeletal Rearrangement of Octasubstituted Semibullvalenes. Journal of the American Chemical Society. 2006, s. 4564–4565. DOI 10.1021/ja0579208. PMID 16594680.
- M. Stinson; D. Ezra; W. M. Hess; J. Sears; G. Strobel. An endophytic Gliocladium sp. of Eucryphia cordifolia producing selective volatile antimicrobial compounds. Plant Science. 2003, s. 913–922. DOI 10.1016/S0168-9452(03)00299-1.
- Eric J. Moorhead; Anna G. Wenzel. Two Undergraduate Experiments in Organic Polymers: The Preparation of Polyacetylene and Telechelic Polyacetylene via Ring-Opening Metathesis Polymerization. Journal of Chemical Education. 2009, s. 973. DOI 10.1021/ed086p973. Bibcode 2009JChEd..86..973M.
- Sango Kunichika. Cyclopolyolefins Derived from Acetylene. Bulletin of the Institute for Chemical Research, Kyoto University. 1953, s. 323–325.
- J. M. Holovka; P. D. Gardner; C. B. Strow; M. L. Hill; T. V. Van Auken. Photolysis and photoisomerization of cyclooctatetraene oxide. Journal of the American Chemical Society. 1968, s. 5041–5043. DOI 10.1021/ja01020a058.
- Thomas J. Katz. The cyclooctatetraenyl dianion. Journal of the American Chemical Society. 1960, s. 3784–3785. DOI 10.1021/ja01499a077.
- JST Nanostructed Materials Project Highlights – Prof. Nakajima's Presentation. www.nanostruct-mater.jst.go.jp [online]. [cit. 2022-01-15]. Dostupné v archivu pořízeném z originálu dne 2008-02-19.
- F. Albert Cotton; Douglas L. Hunter. Carbon-13 Nuclear Magnetic Resonance Study of the Fluxional Behavior of Cyclooctatetraenetricarbonyliron and -Ruthenium. Journal of the American Chemical Society. 1976, s. 1413–1417. DOI 10.1021/ja00422a022.
- R. Pettit; J. Henery. cis-dichlorocyclobutene. Organic Syntheses. 1970, s. 36. DOI 10.15227/orgsyn.050.0036.
- CYCLOBUTADIENE IN SYNTHESIS: Endo-TRICYCLO[4.4.0.02,5]DECA-3,8-DIENE-7,10-DIONE. Organic Syntheses. 1976, s. 43. DOI 10.15227/orgsyn.055.0043.