Acetylacetonáty kovů
Acetylacetonáty kovů jsou komplexní sloučeniny odvozené od bidentátního acetylacetonátového aniontu (zkráceně acac), CH3COCHCOCH −
3 ) a kationtů kovů, obvykle přechodných. Obvykle jsou na kov navázány oba atomy kyslíku, čímž vzniká šestičlenný chelátový kruh. Nejjednodušší acetylacetonáty mají vzorec M(acac)3 a M(acac)2. Existuje též řada víceligandových komplexů, například VO(acac)2. Byly též vyvinuty obměny acetylacetonátového ligandu s mnoha různými substituenty nahrazujícími methylovou skupinu (RCOCHCOR′−).[1]
Mnoho těchto komplexů se, na rozdíl od příslušných halogenidů, rozpouští v organických rozpouštědlech. Vzhledem k těmto vlastnostem se komplexy acac používají jako prekurzory katalyzátorů a reaktantů. Využití mají například v NMR spektroskopii, jako katalyzátory v organické syntéze a k přípravě průmyslových katalyzátorů hydroformylací.
Příprava
Nejčastěji se acetylacetonáty připravují reakcemi solí kovů s acetylacetonem, acacH:[2]
- Mz+ + z Hacac ⇌ M(acac)z + z H+
Přidáním zásady dojde k odštěpení protonu z acetylacetonu a posunu rovnováhy ve prospěch komplexu. Oba atomy kyslíku se naváží na kov a vytvoří šestičlenný chelátový kruh. V některých případech je chelatační efekt tak silný, že k tvorbě komplexu není třeba přítomnost zásady. Některé acetylacetonáty lze získat podvojnou záměnou z Tl(acac).
Struktura
Ve většině svých komplexů acac vytváří šestičlenné C3O2M chelátové kruhy.[3]
M-acac kruhy jsou rovinné a rovině souměrné a aromatické, v C3O2 části jsou elektrony delokalizované. U některých komplexů tak acac může vstoupit do reakcí podobných elektrofilním aromatickým substitucím:[4]
- Co(O2C3Me2H)3 + 3 NO2+ → Co(O2C3Me2NO2)3 + 3 H+
Neutrální bidentátní O,O-vázané acac ligandy jsou typu L-X, tedy spojeními Lewisových zásad (L) a pseudohalogenidů (X).
Rozdělení podle triád
Skupina titanu
Reakcí chloridu titaničitého (TiCl4) s acetylacetonem vzniká cis-TiCl2(acac)2, červeně zbarvený oktaedrický komplex s C2 symetrií:
- TiCl4 + 2 Hacac → TiCl2(acac)2 + 2 HCl
K této reakci není nutná zásada. Komplex TiCl2(acac)2 má v NMR spektru při pokojové teplotě jednu rezonanci methylové skupiny.[5]
Na rozdíl od Ti4+ se na Zr4+ i Hf4+ vážou čtyři acetylacetonátové ionty, což je způsobeno většími poloměry atomů těchto kovů. Acetylacetonát hafničitý a zirkoničitý mají čtvercové antiprismatické struktury.
V rámci titanitých acetylacetonátů je dobře prozkoumanou sloučeninou acetylacetonát titanitý (Ti(acac)3). Jedná se o modře zbarvenou sloučeninu připravovanou z chloridu titanitého a acetylacetonu.[3]
Skupina vanadu

Vanadylacetylacetonát je modrý komplex se vzorcem V(O)(acac)2. Obsahuje vanadylový kation. Molekula má tvar čtvercové pyramidy s C2v symetrií. Používá se jako katalyzátor epoxidací allylalkoholů pomocí peroxidů. Acetylacetonát vanaditý je tmavě hnědý. β-Diketonáty vanadu se používají jako prekatalyzátory při průmyslové výrobě ethylen-propylen-dienových elastomerů. Také slouží ke zvyšování aktivity insulinu a jako prekurzory anorganických látek při chemické depozici z plynné fáze.
Skupina chromu
Acetylacetonát chromitý, Cr(acac)3, je oktaedrický komplex obsahující tři acetylacetonátové ligandy. Podobně jako většina ostatních sloučenin tohoto typu je velmi dobře rozpustný v nepolárních organických rozpouštědlech. Tento komplex, mající tři nepárové elektrony, se používá ke zlepšování citlivosti kvantitativní 13-C NMR spektroskopie.[6]
Acetylacetonát chromnatý je světle hnědou sloučeninou citlivou na přítomnost vzduchu. Má čtvercově rovinnou geometrii. Je izomorfní s Pd(acac)2 a Cu(acac)2.[7]
Skupina manganu
manganese(III)-3D-balls.png.webp)
Mn(acac)3 lze připravit synproporcionační reakcí manganaté sloučeniny Mn(acac)2 s manganistanem draselným za přidání acetylacetonu.[8] Další možností je přímá reakce acetylacetonu s manganistanem draselným.[9] Mn(acac)3 patří mezi vysokospinové komplexy. Jeho oktaedrická struktura je narušena Jahnovým–Tellerovým efektem.
Dvojici nejčastějších struktur této sloučeniny tvoří jedna tetragonální s prodlouženými vazbami a druhá tetragonální s vazbami zkrácenými. U prodloužené mají dvě vazby Mn–O délku 212 pm a zbylé čtyři 193 pm. Zkrácená struktura obsahuje dvě vazby Mn–O o délce 195 pm a čtyři o délce 200 pm. Z těchto údajů je vidět, že prodloužení se projevuje výrazněji než zkrácení.
V organické chemii se Mn(acac)3 používá jako jednoelektronové oxidační činidlo při párováních fenolů.[10][11]
Skupina železa
Acetylacetonát železitý, Fe(acac)3, je červeně zbarvený vysokospinový komplex s pěti nepárovými elektrony, dobře rozpustný v organických rozpouštědlech. Zkoumá se jako možný prekurzor katalyzátorů.[12]
Fe(acac)3 má dva optické izomery, Δ a Λ; ty je možné oddělit od sebe.[13]
Obdobný železnatý komplex Fe(acac)2 vytváří oligomer.
Podobně jako železo tvoří i ruthenium stabilní tris(acetylacetonát). Jeho redukcí za přítomnosti dalších ligandů vznikají víceligandové komplexy, jako například Ru(acac)2(alken)2.[14]
Skupina kobaltu
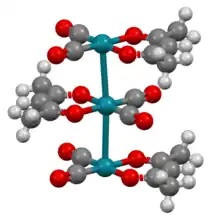
Acetylacetonát kobaltitý, Co(acac)3, je nízkospinový diamagnetický komplex. Podobně jako i jiné sloučeniny typu M(acac)3 je chirální.[13]
Co(acac)3 se připravuje z kobaltnatých sloučenin a je tak třeba přidat oxidační činidlo:
- 2 CoCO3 + 6 Hacac + H2O2 → 2 Co(acac)3 + 4 H2O + 2 CO2
Sloučenina Co(acac)2, podobně jako odpovídající komplexy niklu, bývá obvykle izolována se dvěma ligandy navíc jako oktaedrický komplex Co(acac)2L2. Bezvodá forma se vyskytuje jako tetramer [Co(acac)2]4, jenž má, podobně jako trimerní komplex niklu, za nízkých teplot feromagnetické vlastnosti.[15]
Jsou také popsány iriditý (Ir(acac)3) a rhoditý (Rh(acac)3) acetylacetonát. Iriditý má také druhý izomer, trans-Ir(acac)2(CH(COMe)2)(H2O). Používá se na přípravu homogenních katalyzátorů aktivací vazeb uhlík-vodík a podobných reakcí. [16][17][18][19]
Jsou také známy dikarbonyl(acetylacetonát) rhodný (Rh(acac)(CO)2) a iridný, což jsou čtvercové komplexy s C2v symetrií.
Skupina niklu
nickel(II)-3D-sticks.png.webp)
Acetylacetonát nikelnatý se vyskytuje jako trimer, [Ni(acac)2]3. Beta-diketonáty s objemnými substituenty vytváří červené, monomerní a čtvercové komplexy.[20]
Acetylacetonát nikelnatý reaguje s vodou za vzniku zeleně zbarveného oktaedrického komplexu [Ni(acac)2(H2O)2.[21]
Oproti složitým strukturním a magnetickým vlastnostem nikelnatého ekvivalentu jsou acetylacetonát platnatý a palladnatý diamagnetické a monomerní sloučeniny.
Skupina mědi
Acetylacetonát měďnatý (Cu(acac)2) se připravuje z acetylacetonu a vodného roztoku Cu(NH3) 2+
4 . Tato komerčně dostupná látka se používá jako katalyzátor párovacích reakcí a reakcí s přesuny karbenů.
Na rozdíl od příslušné mědnaté sloučeniny je acetylacetonát měďný oligomer, citlivý na přítomnost vzduchu. Slouží jako katalyzátor Michaelových reakcí.[22]
Skupina zinku
Monoaquokomplex Zn(acac)2H2O, tající při 138 až 140 °C, má čtvercově pyramidální strukturu.[23] Tento komplex má využití v organické syntéze.[24]
Dehydratací této sloučeniny vzniká hygroskopický bezvodý produkt s teplotou tání 127 °C.[25] Tato těkavější sloučenina byla použita na tvorbu tenkých vrstev oxidu zinečnatého.
Acetylacetonáty jiných prvků
Bezbarvý diamagnetický komplex Al(acac)3 je strukturně podobný ostatním tris(acetylacetonát)ům, jako je například [Fe(acac)3]. Tris(acetylacetonát)y lanthanoidů mají často koordinační čísla vyšší než 8.
Obměny acac
Je známa řada obměn acetylacetonátového aniontu. Hexafluoracetylacetonáty a trifluoracetylacetonáty vytváří komplexy, které jsou často strukturně podobné acetylacetonátům a vykazují vyšší Lewisovskou kyselost i těkavost. Komplex EuFOD, Eu(OCC(CH3)3CHCOC3F7)3, funguje jako Lewisova kyselina a vytváří adukty s tvrdými zásadami.
Jeden nebo oba atomy kyslíku v acetylacetonátovém iontu lze nahradit RN skupinami; takto jsou odvozeny ligandy nacac a nacnac.
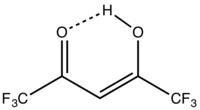 hexafluoracetylaceton
hexafluoracetylaceton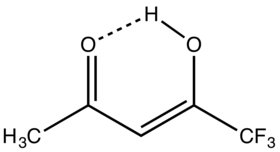 trifluoracetylaceton
trifluoracetylaceton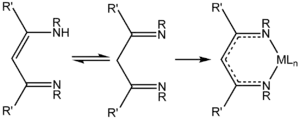 tautomery a komplexace naccnac
tautomery a komplexace naccnac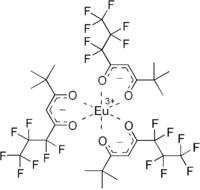 NMR reaktant EuFOD
NMR reaktant EuFOD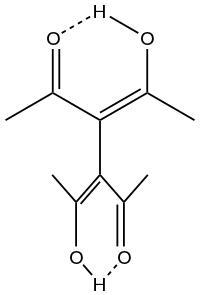 Tetraacetylethan, sloučenina vytvářející komplexy s dvojicemi kovových atomů[26]
Tetraacetylethan, sloučenina vytvářející komplexy s dvojicemi kovových atomů[26]
C-vázané acetylacetonáty
C5H7O −
2 se někdy na kovy váže přes centrální atom uhlíku (C3); tento druh komplexů se častěji vyskytuje u iontů přechodných kovů třetí řady, jako jsou Pt2+ a Ir3+. Ir(acac)3 a jeho adukty s Lewisovými zásadami Ir(acac)3L (L = amin) obsahují vždy jeden acac ligand vázaný přes atom uhlíku. Infračervená spektra acetylacetonátů vázaných přes kyslík obsahují poměrně nízkoenergetické νCO pásy na 1535 cm−1,zatímco u těch vázaných přes uhlík se objevují karbonylové vibrace blíže k běžným ketonovým vazbám C=O (1655 cm−1).
Reference
V tomto článku byl použit překlad textu z článku Metal acetylacetonates na anglické Wikipedii.
- M. Albrecht; S. Schmid; M. De Groot; P. Weis; R. Fröhlich. Self-assembly of an Unpolar Enantiomerically Pure Helicate-type Metalla-cryptand. Chemical Communications. 2003, s. 2526–2527. DOI 10.1039/b309026d. PMID 14594263.
- R. C. Mehrotra; R. Bohra; D. P. Gaur. Metal ß-Diketones and Allied Derivatives. [s.l.]: Academic Press, 1978. ISBN 0124881505.
- Evrim Arslan; Roger A. Lalancette; Ivan Bernal. An Historic and Scientific Study of the Poperties of Metal(III) Tris-acetylacetonates. Structural Chemistry. 2017, s. 201–212. DOI 10.1007/s11224-016-0864-0.
- George M. Shalhoub. Co(acac)3 Synthesis, Reactions, and Spectra: An Experiment for General Chemistry. Journal of Chemical Education. 1980, s. 525. DOI 10.1021/ed057p525. Bibcode 1980JChEd..57..525S.
- C. A. Wilkie; G. Lin; D. T. Haworth. Cis-[Dihalobis(2,4-Pentaedionato)Titanium(IV)] Complexes. Inorganic Syntheses. 1979, s. 145–148. ISBN 9780470132500. DOI 10.1002/9780470132500.ch33.
- Elsa Caytan; Gerald S. Remaud; Eve Tenailleau; Serge Akoka. Precise and accurate quantitative 13C NMR with reduced experimental time. Talanta. 2007, s. 1016–1021. DOI 10.1016/j.talanta.2006.05.075. PMID 19071407.
- F. A. Cotton; C. E. Rice; G. W. Rice. The Crystal and Molecular Structures of Bis(2,4-pentanedionato)chromium. Inorganica Chimica Acta. 1977, s. 231–234. DOI 10.1016/S0020-1693(00)93880-5.
- R. G. Charles. Acetylacetonate manganese(III). Inorganic Syntheses. 1963, s. 183–184. ISBN 9780470132388. DOI 10.1002/9780470132388.ch49.
- Girolami, G.; Rauchfuss, T.; Angelici, R. Synthesis and Technique in Inorganic Chemistry, 3rd ed.; University Science Books: Sausalito, CA, 1999; pp. 85-92 ISBN 0-935702-48-2
- B. B. Snider. Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons, 2001. ISBN 0471936235. DOI 10.1002/047084289X.rm022. Kapitola Manganese(III) Acetylacetonate.
- W. Fawcett; M. Opallo. Kinetic parameters for heterogeneous electron transfer to tris(acetylacetonato)manganese(III) and tris(acetylacetonato)iron(III) in aprotic solvents. Journal of Electroanalytical Chemistry. 1992, s. 815–830. DOI 10.1016/0022-0728(92)85008-Q.
- S. A. Richert; P. K. S. Tsang; D. T. Sawyer. Ligand-centered redox processes for manganese, iron and cobalt, MnL3, FeL3, and CoL3, complexes (L = acetylacetonate, 8-quinolinate, picolinate, 2,2′-bipyridyl, 1,10-phenanthroline) and for their tetrakis(2,6-dichlorophenyl)porphinato complexes [M(Por)]. Inorganic Chemistry. 1989, s. 2471–2475. DOI 10.1021/ic00311a044.
- Anders Lennartson. Optical resolution and racemisation of [Fe(acac)3]. Inorganica Chimica Acta. 2011, s. 451–453. DOI 10.1016/j.ica.2010.07.066.
- M. A. Bennett; G. A. Heath; D. C. R. Hockless; I. Kovacik; A. C. Willis. Alkene Complexes of Divalent and Trivalent Ruthenium Stabilized by Chelation. Dependence of Coordinated Alkene Orientation on Metal Oxidation State. Journal of the American Chemical Society. 1998, s. 932–941. DOI 10.1021/ja973282k.
- V. D. Vreshch; J.-H. Yang; H. Zhang; A. S. Filatov; E. V. Dikarev. Monomeric Square-Planar Cobalt(II) Acetylacetonate: Mystery or Mistake?. Inorganic Chemistry. 2010, s. 8430–8434. DOI 10.1021/ic100963r. PMID 20795642.
- M. A. Bennett; T. R. B. Mitchell. γ-Carbon-bonded 2,4-pentanedionato complexes of trivalent iridium. Inorganic Chemistry. 1976, s. 2936–2938. DOI 10.1021/ic50165a079.
- G. Bhalla; J. Oxgaard; W. A. Goddard; Roy A. Periana. Hydrovinylation of Olefins Catalyzed by an Iridium Complex via CH Activation. authors.library.caltech.edu. 2005, s. 5499–5502. Dostupné online. DOI 10.1021/om050614i.
- A. G. Wong-Foy; G. Bhalla; X. Y. Liu; R. A. Periana. Alkane C–H Activation and Catalysis by an O-Donor Ligated Iridium Complex. Journal of the American Chemical Society. 2003, s. 14292–14293. DOI 10.1021/ja037849a. PMID 14624574.
- William J. Tenn; Kenneth J. H. Young; Gaurav Bhalla; Jonas Oxgaard; William A. Goddard; Roy A. Periana. CH Activation with an O-Donor Iridium-Methoxo Complex. Journal of the American Chemical Society. 2005, s. 14172–14173. Dostupné online. DOI 10.1021/ja051497l. PMID 16218597.
- A. Döhring; R. Goddard; P. W. Jolly; C. Krüger; V. R. Polyakov. Monomer–Trimer Isomerism in 3-Substituted Pentane-2,4-dione Derivatives of Nickel(II). Inorganic Chemistry. 2007, s. 177–183. DOI 10.1021/ic960441c.
- Paul Williams, Anthony Jones, Jamie Bickley, Alexander Steiner, Hywel Davies, Timothy Leedham, Susan Impey, Joanne Garcia, Stephen Allen, Aline Rougier, Alexandra Blyr. Synthesis and crystal structures of dimethylaminoethanol adducts of Ni(ii) acetate and Ni(ii) acetylacetonate. Precursors for the sol–gel deposition of electrochromic nickel oxide thin films. Journal of Materials Chemistry. 2001-08-02, s. 2329–2334. Dostupné online [cit. 2021-10-09]. DOI 10.1039/B103288G.
- E. J. Parish; S. Li. Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons, 2004. ISBN 0471936235. DOI 10.1002/047084289X.rc203. Kapitola Copper(I) Acetylacetonate.
- H. Montgomery; E. C. Lingafelter. The crystal structure of monoaquobisacetylacetonatozinc. Acta Crystallographica. 1963. DOI 10.1107/S0365110X6300195X.
- N. Barta. Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons, 2004. ISBN 0471936235. DOI 10.1002/047084289X.rb097.
- G. Rudolph; M. C. Henry. Bis(2,4-Pentanedionato)zinc (Zinc Acetylacetonate). Inorganic Syntheses. 1967, s. 74–77. DOI 10.1002/9780470132418.ch14.
- KOIWA, Tomohiro; MASUDA, Yuki; SHONO, Junpei; KAWAMOTO, Yuji; HOSHINO, Yoshimasa; HASHIMOTO, Takeshi; NATARAJAN, Karuppannan. Synthesis, Characterization, and Detailed Electrochemistry of Binuclear Ruthenium(III) Complexes Bridged by Bisacetylacetonate. Crystal and Molecular Structures of [{Ru(acac)2}2(tae)] (Acac = 2,4-Pentanedionate Ion, tae = 1,1,2,2-Tetraacetylethanate Dianion). Inorganic Chemistry. 2004, s. 6215–6223. DOI 10.1021/ic030216c. PMID 15446866. (anglicky)
_acac.png.webp)

_acac.png.webp)