Pentakarbonyl železa
Pentakarbonyl železa (též jen karbonyl železa; systematický název pentakarbonylželezo) je sloučenina se vzorcem Fe(CO)5. Za normálních podmínek jde o slámově zbarvenou kapalinu štiplavého zápachu. Je běžným prekurzorem různých sloučenin železa, včetně mnoha takových, které se používají v organické syntéze.[1] Připravuje se reakcí jemných částic železa s oxidem uhelnatým. Jedná se o relativně levnou chemikálii.[zdroj?]
| Pentakarbonyl železa | |
|---|---|
5.png.webp)
Pentakarbonyl železa - strukturní vzorec | |
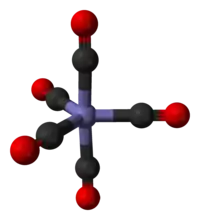
Pentakarbonyl železa - model molekuly | |
| Obecné | |
| Systematický název | pentakarbonylželezo |
| Triviální název | karbonyl železa |
| Ostatní názvy | pentakarbonyl železa |
| Anglický název | Iron pentacarbonyl |
| Německý název | Eisenpentacarbonyl |
| Funkční vzorec | Fe(CO)5. |
| Sumární vzorec | FeC5O5 |
| Vzhled | slámově žlutá kapalina |
| Identifikace | |
| Registrační číslo CAS | 13463-40-6 |
| PubChem | 26040 |
| UN kód | 1994 |
| Číslo RTECS | NO4900000 |
| Vlastnosti | |
| Molární hmotnost | 195,90 g/mol |
| Teplota tání | −20 °C |
| Teplota varu | 103 °C |
| Hustota | 1,45 g/cm³ |
| Rozpustnost ve vodě | nerozpustný |
| Struktura | |
| Krystalová struktura | trigonální bipyramidální |
| Koordinační geometrie | trigonální bipyramidální |
| Dipólový moment | 0 D |
| Bezpečnost | |
| R-věty | R11 R26/27/28 |
| S-věty | S16 S45 S26 S28 S36/37 S39 |
| NFPA 704 |  1
4
3
|
| Teplota vzplanutí | −15 °C |
| Teplota vznícení | 50 °C |
| Meze výbušnosti | 3,7–12,5 % |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Pentakarbonyl železa je jedním z homoleptických karbonylů kovů; tzn. že oxid uhelnatý je zde jediným ligandem komplexu s železem. Mezi další příklady patří osmistěnný hexakarbonyl chromu a čtyřstěnný tetrakarbonyl niklu. Většina kovových karbonylů má 18 valenčních elektronů; Fe(CO)5 tomuto vzoru odpovídá tak, že má osm elektronů na atomu železa a pět párů elektronů poskytnutých ligandy CO. Vzhledem k symetrické struktuře a neutralitě náboje je Fe(CO)5 těkavý. Je jedním z nejrozšířenějších kapalných kovových komplexů. Má trigonální bipyramidální strukturu, kde je atom železa obklopen pěti ligandy CO; tři jsou v příčných (rovníkových) pozicích a dva jsou vázány osově. Vazby Fe-C-O jsou lineární.
Fe(CO)5 je archetypem fluxionální (proměnlivé) molekuly, vzhledem k rychlé výměně osových a příčných skupin CO prostřednictvím Berryho mechamismu na časové ose NMR. V důsledku toho vykazuje NMR spektrum 13C pouze jeden signál jako znak rychlé výměny mezi neekvivalentními pozicemi CO.
Karbonyl železa se někdy plete s karbonylovým železem, což je vysoce čistý kov připravovaný rozkladem pentakarbonylu železa.
Toxicita a bezpečnost
Fe(CO)5 je toxický (ovšem méně než například tetrakarbonyl niklu) a může být nebezpečný kvůli své těkavosti (tlak par: 21 mmHg při 20 °C). Při vdechování může způsobit podráždění plic, toxickou pneumonitidu nebo edém plic. Podobně jako jiné karbonyly je hořlavý.
Reference
V tomto článku byl použit překlad textu z článku Iron pentacarbonyl na anglické Wikipedii.
- Samson, S. ; Stephenson, G. R. "Pentacarbonyliron" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
Externí odkazy
 Obrázky, zvuky či videa k tématu Pentakarbonyl železa na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pentakarbonyl železa na Wikimedia Commons

