E2 reakce
E2 reakce je označení typu eliminační reakce, kde E označuje eliminaci a číslice 2 ukazuje, že jde o bimolekulární reakci.
Model mechanismu takové reakce vytvořil ve 20. letech 20. století Christopher Kelk Ingold. Mechanismus obsahuje jediný krok, při něm zanikají vazby uhlík-vodík a halogen-vodík za vzniku dvojné vazby mezi dvěma uhlíky (C=C).
E2 reakce mají tyto charakteristické vlastnosti:
- Probíhají v jediném kroku, vytváří se pouze jeden přechodný stav.
- Obvykle probíhají u primárních alkylhalogenidů, někdy ale i sekundárních alkylhalogenidů i jiných sloučenin.
- Reakce je druhého řádu, protože je ovlivněná alkylhalogenidem i zásadou.
Jelikož při E2 reakcích vznikají vazby pí, tak musí být obě odstupující skupiny (často vodík a halogen) navzájem v antiperiplanární poloze. Antiperiplanární přechodný stav je v nezákrytové konformaci a má nižší energii než synperiplanární, který by byl v zákrytové konformaci. Mechanismus s nezákrytovou konformací je u E2 reakcí pravděpodobnější (na rozdíl od E1 reakcí).
- Při E2 reakcích se obvykle používají silné zásady. Zásada musí být dostatečně silná na to, aby mohla odtrhnout slabě kyselý vodík.
- Aby vznikla vazba pí, tak se hybridizace uhlíků změní z sp3 na sp2.
- Vazba C-H je v kroku určujícím rychlost reakce oslabena a nastává tak deuteriový izotopový efekt o hodnotě výrazně větší než 1 (obvykle 2 až 6).
- Současně s E2 reakcí probíhá také zpětná SN2 reakce, pokud může zásada také fungovat jako nukleofil (což je vlastnost mnoha běžných zásad).
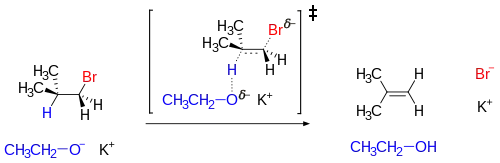
Příkladem E2 reakce je následující reakce isobutylbromidu s ethoxidem draselným v ethanolu, jejímiž produkty jsou isobuten, ethanol a bromid draselný:
Reference
V tomto článku byl použit překlad textu z článku Elimination reaction na anglické Wikipedii.