Mannichova reakce
Mannichova reakce je organická reakce spočívající v aminoalkylaci kyselého protonu umístěného vedle karbonylové funkční skupiny pomocí formaldehydu a amoniaku nebo primárního či sekundárního aminu. Konečnými produkty Mannichových reakcí jsou β-amino-karbonylové sloučeniny, také nazývané Mannichovy zásady. K Mannichovým reakcím se také řadí reakce aldiminů s α-methylenkarbonylovými sloučeninami, protože aldiminy tvoří přechod mezi aminy a aldehydy.
Reakci objevil německý chemik Carl Mannich.[1][2]

Mannichova reakce patří mezi nukleofilní adice aminové skupiny na karbonyl následované dehydratací za tvorby Schiffovy báze. Schiffovy báze jsou poté použity jako elektrofily, které reagují v elektrofilních adicích s molekulami obsahujícími kyselý proton. Mannichova reakce bývá také řazena mezi kondenzační reakce.
Primární nebo sekundární aminy slouží při Mannichově reakci k aktivaci formaldehydu. Terciární aminy nemají vazbu N-H potřebnou k tvorbě enaminového meziproduktu. K nukleofilům s kyselým vodíkem navázaným na uhlík patří karbonylové sloučeniny, nitrily, acetyleny, alifatické nitrosloučeniny, iminy a α-alkyl-pyridiny. Lze rovněž použít aktivované fenylové skupiny a heterocykly s vysokou elektronovou hustotou, jako jsou furany, pyrroly a thiofeny; obzvláště aktivními substráty jsou indoly.
Mechanismus
Mannichova reakce začíná tvorbou iminiového kationtu z aminu a formaldehydu:
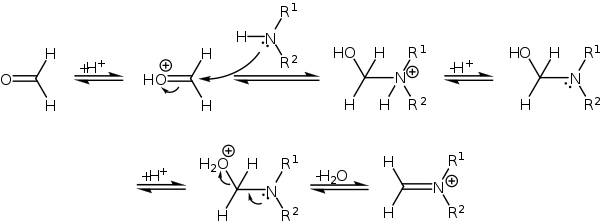
Poté karbonylová sloučenina (zde je použit keton) se může tautomerizovat na enol, který následně reaguje s iminiovým iontem:
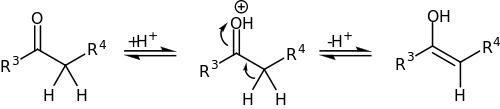
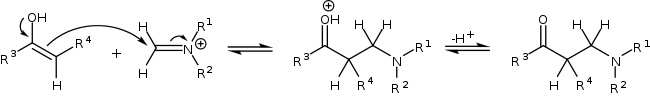
U methylketonů může enolizace a následná Mannichova adice proběhnout dvakrát, přičemž poté dojde k β-eliminaci za vzniku derivátů β-aminoenonů.[3][4]
Asymetrické Mannichovy reakce
Byly také vyvinuty asymetrické Mannichovy reakce. Při správné funkcionalizaci se na ethylenovém můstku produktu Mannichovy reakce vytvoří dvě prochirální centra, která mohou vytvořit dvě dvojice enantiomerů. První asymetrická reakce s nepozměněným aldehydem byla provedena pomocí (S)-prolinu, použitého jako přírodní chirální katalyzátor.[5]
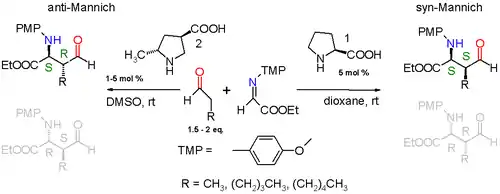
Také byla popsána Mannichova reakce jednoduchého aldehydu (například propionaldehydu) s iminem získaným realci ethylesteru kyseliny glyoxalové s p-methoxyanilinem katalyzovaná (S)-prolinem a prováděná v 1,4-dioxanu při pokojové teplotě. Reakce probíhá diastereospecificky, syn-produkt převažuje nad anti-produktem převažujícím produktem v poměru 3:1, pokud je aldehyd substituován methylovou skupinou, a v poměru 19:1, pokud je substituován pentylovou skupinou. Z obou možných syn-produktů (S,S) a (R,R) se ve větším množství tvoří (S,S)-enantiomer, jehož enantiomerní přebytek je přes 99 %.

Prolin zahajuje katalytický cyklus reakcí s aldehydem za tvorby enaminu. Následně imin reaguje Si-faciálně s enaminem. Z důvodu menšího sterického napětí jsou enaminová a iminová skupina navzájem v antiperiplanární poloze, což vede k výrazné převaze syn-adice nad anti-adicí. Na enantioselektivitu mají také vliv vodíkové vazby mezi karboxylovou skupinou prolinu a iminem. Meziproduktem je devítičlenný cyklus s židličkovou konformací obsahující vazby s přechodnými vlastnostmi mezi jednoduchou a dvojnou vazbou. Nakonec se obnoví prolinová skupina a vytvoří (S,S) produkt.
Pozměněním prolinového katalyzátoru lze dosáhnout i vzniku anti-izomerů.[6]
Při přidání další methylové skupiny na prolin bude meziproduktem desetičlenný cyklus a vznikat bude anti produkt. Diastereoselektivita anti produktů vůči syn-produktům bude přinejmenším v poměru 95:5 a (S,R) enantiomer bude vznikat s nejméně 97% enantiomerním přebytkem.
Využití
Mannichova reakce se často používá v organické syntéze. Příklady jsou výroba a příprava:
- alkylaminů
- peptidů, nukleotidů, antibiotik a alkaloidů (například tropinonu)
- agrochemikálií, například regulátorů růstu rostlin
- polymerů
- katalyzátorů
- léčiv (například rolitetracyklinu, který je produktem Mannichovy reakce tetracyklinu s pyrrolidinem, fluoxetinu, tramadolu a tolmetinu)
- detergentů
- α,β-nenasycených ketonů tepelným rozkladem produktů Mannichovy reakce (například methylvinylketonu z 1-diethylamino-butan-3-onu)
Reference
V tomto článku byl použit překlad textu z článku Mannich reaction na anglické Wikipedii.
- C. Mannich; W. Krösche. Ueber ein Kondensationsprodukt aus Formaldehyd, Ammoniak und Antipyrin. Archiv der Pharmazie. 1912, s. 647–667. Dostupné online. DOI 10.1002/ardp.19122500151.
- F. F. Blicke. The Mannich Reaction. Organic Reactions. 2011, s. 303–341. ISBN 978-0471264187. DOI 10.1002/0471264180.or001.10.
- Norman H. Cromwell; David S. Soriano; Earl Doomes. Mobile keto allyl systems. 18. Synthesis and chemistry of N-substituted and N,N-disubstituted 2-benzoyl-1-amino-3-propenes. The Journal of Organic Chemistry. 1980, s. 4983–4985. Dostupné online. DOI 10.1021/jo01312a034.
- Ulrich Girreser; Dieter Heber; Martin Schütt. A Facile One-Pot Synthesis of 1-Aryl-2-(dimethylaminomethyl)prop-2-en-1-ones from Aryl Methyl Ketones. Synthesis. 1998, s. 715–717. DOI 10.1055/s-1998-2056.
- A. Córdova; S.-I. Watanabe; F. Tanaka; W. Notz; C. F. Barbas. A highly enantioselective route to either enantiomer of both α- and β-amino acid derivatives. Journal of the American Chemical Society. 2002, s. 1866–1867. DOI 10.1021/ja017833p. PMID 11866595.
- S. Mitsumori; H. Zhang; P. H.-Y. Cheong; K. Houk; F. Tanaka; C. F. Barbas. Direct asymmetric anti-Mannich-type reactions catalyzed by a designed amino acid. Journal of the American Chemical Society. 2006, s. 1040–1041. DOI 10.1021/ja056984f. PMID 16433496.
Externí odkazy
 Obrázky, zvuky či videa k tématu Mannichova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Mannichova reakce na Wikimedia Commons