Kyselina fosforitá
Kyselina fosforitá (přesněji dihydroxyfosfanoxid), též kyselina fosfonová, je bílá krystalická látka, jedna z mnoha kyselin fosforu.
| Kyselina fosforitá | |
|---|---|
 | |
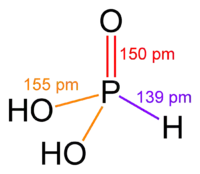 | |
| Obecné | |
| Systematický název | dihydroxyfosfanoxid |
| Ostatní názvy | kyselina fosfonová kyselina fosforitá |
| Anglický název | Phosphorous acid |
| Německý název | Phosphonsäure |
| Sumární vzorec | H3PO3 |
| Vzhled | Bezbarvá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 13598-36-2 |
| 10294-56-1 | |
| EC-no (EINECS/ELINCS/NLP) | 237-066-7 |
| Indexové číslo | 015-157-00-0 |
| SMILES | OP(=O)O |
| InChI | 1S/H3O3P/c1-4(2)3/h4H,(H2,1,2,3) |
| Číslo RTECS | SZ6400000 |
| Vlastnosti | |
| Molární hmotnost | 81,996 g/mol |
| Teplota tání | 73,6 °C |
| Teplota rozkladu | 200 °C |
| Hustota | 1,821 g/cm³ (20 °C) 1,651 g/cm³ (21,2 °C) |
| Index lomu | 1,431 5 |
| Disociační konstanta pKa | 1,8 (první) 6,15 (druhá) |
| Rozpustnost ve vodě | 309 g/100 g (0 °C) 476 g/100 g (25,4 °C) 694 g/100 g (40 °C) |
| Rozpustnost v polárních rozpouštědlech |
Rozpustná v ethanolu |
| Měrná magnetická susceptibilita | −5,78×10−6 cm3 g−1 |
| Struktura | |
| Krystalová struktura | Kosočtverečná |
| Hrana krystalové mřížky | a=727 pm b= 1 206 pm c= 685 pm |
| Koordinační geometrie | Tetraedr |
| Tvar molekuly | Čtyřstěn |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −975,6 kJ/mol |
| Entalpie tání ΔHt | 181 J/g |
| Standardní molární entropie S° | 167 J K−1 mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −875,5 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H302 H314 |
| R-věty | R22, R35 |
| S-věty | S1/2, S26, S36/37/39, S45 |
| NFPA 704 |  0
2
4
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Nomenklatura a tautomerismus
H3PO3 se přesněji popisuje vzorcem HPO(OH)2. Tato molekula existuje v rovnováze s menšinovým tautomerem P(OH)3. Podle doporučení IUPAC z roku 2005 se tato první forma označuje kyselina fosfonová, kdežto forma druhá jako kyselina fosforitá.[2]
Příprava
Vzniká sice reakcí oxidu fosforitého s vodou za chladu
- P2O3 + 3 H2O → 2 H3PO3,
za tepla však místo toho vzniká směs kyseliny fosforečné a fosfanu
- 2 P2O3 + 6 H2O → PH3 + 3 H3PO4.
Proto se obvykle připravuje hydrolýzou chloridu fosforitého nebo bromidu fosforitého
- PCl3 + 3 H2O → H3PO3 + 3 HCl,
- PBr3 + 3 H2O → H3PO3 + 3 HBr.
Chemické vlastnosti
Přestože molekula kyseliny fosfonové obsahuje tři atomy vodíku, a zdálo by se, že v této molekule je fosfor trojmocný, je molekula této látky nesymetrická. Jeden z atomů vodíku je vázán přímo na atom fosforu a zbývající dva vodíkové atomy jsou na fosfor vázány přes kyslík. To znamená, že ve vodném roztoku se kyselina fosfonová disociuje pouze do druhého stupně, je tedy pouze dvojsytná. To znamená, že tvoří „jen“ dvě řady solí, a to dihydrogenfosfonany a hydrogenfosfonany. Dihydrogenfosforitanový aniont má náboj -1, a hydrogenfosforitanový -2 ([H2PO3]1− resp. [HPO3]2−).
Zahříváním se rozkládá na kyselinu fosforečnou a fosfan
- 4 H3PO3 → PH3 + 3 H3PO4.
Ve vodném roztoku se samovolně pomalu oxiduje vzdušným kyslíkem na kyselinu fosforečnou
- 2 H3PO3 + O2 → 2 H3PO4.
Vzhledem k tomu je kyselina fosforitá redukčním činidlem, které je např. schopno redukovat soli jednomocného stříbra na kov, např.
- 2 AgNO3 + H3PO3 + H2O → 2 Ag + 2 HNO3 + H3PO4,
nebo sloučeniny dvojmocné rtuti na jednomocné
Reference
V tomto článku byl použit překlad textu z článku Phosphorous acid na anglické Wikipedii.
- Phosphorous acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Mezinárodní unie pro čistou a užitou chemii (2005). Názvosloví anorganické chemie (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. Elektronická verze..
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina fosfonová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina fosfonová na Wikimedia Commons

