Acetylacetonát nikelnatý
Acetylacetonát nikelnatý, zkráceně Ni(acac)2, je nikelnatý komplex s acetylacetonátovými (acac) ligandy, patřící mezi acetylacetonáty kovů. Jedná se o tmavě zelenou paramagnetickou pevnou látku, rozpustnou v organických rozpouštědlech. S vodou reaguje za vzniku modrozeleného diaquokomplexu Ni(acac)2(H2O)2.[2]
| Acetylacetonát nikelnatý | |
|---|---|
Struktura | |
_acetylacetonate.jpg.webp)
Vzhled | |
| Obecné | |
| Systematický název | (Z)-4-oxopent-2-en-2-olát nikelnatý |
| Sumární vzorec | C10H14NiO4 |
| Vzhled | tmavě zelená pevná látka |
| Identifikace | |
| Registrační číslo CAS | 3264-82-2 |
| EC-no (EINECS/ELINCS/NLP) | 221-875-7 |
| PubChem | 5359853 |
| SMILES | CC(=CC(=O)C)O.CC(=CC(=O)C)O.[Ni] |
| InChI | 1S/2C5H8O2.Ni/c2*1-4(6)3-5(2)7;/h2*3,6H,1-2H3;/b2*4-3-; |
| Vlastnosti | |
| Molární hmotnost | 256,91 g/mol |
| Teplota rozkladu | 229,5 °C (502,6 K) |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v toluenu |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H317 H334 H350[1] |
| P-věty | Neznámá věta P203 P261 P264 P270 P272 P280 P284 Neznámá věta P301+317 P302+352 P304+340 Neznámá věta P318 P321 P330 P333+313 Neznámá věta P342+316 Neznámá věta P362+364 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
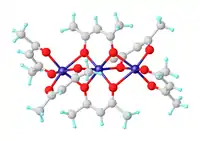
Struktura a vlastnosti
Bezvodý komplex
Bezvodý acetylacetonát nikelnatý vytváří trimerní molekuly se vzorcem Ni3(acac)6. Trojice atomů niklu se téměř v jedné přímce a mezi každými dvěma jsou dva μ2 atomy kyslíku. Atomy niklu mají tetragonálně narušenou oktaedrickou geometrii; narušení je způsobeno různými délkami vazeb Ni-O u můstkových a nemůstkových kyslíků.[3]
Molekuly Ni3(acac)6 jsou slabě vychýlené od středové souměrnosti.[4]
Díky trimerní struktuře mohou atomy Ni dohromady vytvořit oktaedrickou strukturu. Trimer vzniká pouze tehdy, když dochází ke sdílení kyslíkových center mezi dvojicemi atomů niklu.
Bezvodý komplex je při teplotách pod 80 K paramagnetický s efektivním magnetickým momentem 3,2 μB. Efektivní moment se při 4,3 K zvyšuje na 4,1 μB, což je způsobováno feromagnetickými výměnnými interakcemi, kterých se účastní všechny tři nikelnaté ionty.[5]
U objemnějších analogů acetylacetonátového ligandu, jako jsou 3-methylacetylacetonáty,[6] sterické efekty způsobují převahu monomerů.
Dihydrát
2(H2O)2.png.webp)
Podobně jako v bezvodém acetylacetonátu i u dihydrátu zaujímají Ni2+ centra oktaedrickou geometrii. Koordinační sféru vytvářejí dva bidentátní acetylacetonátové (acac) a dva aqua ligandy. Ni(acac)2(H2O)2 se vyskytuje jako cis a trans izomer.[7]
Trans-izomer převažuje (cis-izomer byl pozorován pouze v případech, kdy jako rozpouštědlo sloužil pyridin-N-oxid).[8]
U trans-izomeru je skupina X axiální, v ethanolu tvoří vazby Ni-O. Tyto axiální vazby jsou delší (210,00 pm) delší než ekvatoriální (200,85 a 199,61 pm).[9]
2.png.webp)
Příprava
Acetylacetonát nikelnatý se připravuje reakcí dusičnanu nikelnatého s acetylacetonem za přítomnosti zásady. Vzniká přitom modrozelený diaquakomplex Ni(CH3COCHCOCH3)2(H2O)2.[10]
- Ni(NO3)2 + 2 CH3COCH2COCH3 + 2 H2O + 2 NaOH → Ni(CH3COCHCOCH3)2(H2O)2 + 2 NaNO3
Tento komplex lze dehydratovat azeotropní destilací pomocí Deanovy–Starkovy aparatury:[10]
- 3 Ni(CH3COCHCOCH3)2(H2O)2 → [Ni(CH3COCHCOCH3)2]3 + 6 H2O
Bezvodou formu lze získat i sublimací Ni(acac)2(H2O)2 za teploty 170–210 °C a nízkého tlaku (0,03-0,05 kPa).[4]
Reakce
Bezvodý komplex reaguje s Lewisovými zásadami za tvorby monomerních aduktů.[11]
Jako příklad lze uvést reakci s tetramethylethylendiaminem (tmeda):[12]
- [Ni(CH3COCHCOCH3)2]3 + 3 tmeda → 3 Ni(CH3COCHCOCH3)2(tmeda)
Ni(acac)2(H2O)2 vykazuje vysokou reaktivitu na methinových pozicích, například s izokyanáty vytváří diamidy. Podobně reaguje i s diethylazodikarboxylátem a dimethylacetylendikarboxylátem:
- Ni(acac)2(H2O)2 + 2 PhNCO → Ni(O2C5Me2C(O)NHPh)2 + 2 H2O
Použití
Bezvodý acetylacetonát nikelnatý slouží na přípravu niklových katalyzátorů, jako je bis(cyklooktadien)nikl.
[Ni(acac)2]3 je též prekurzorem při vytváření tenkých vrstev oxidu nikelnatého na vodivých sklech.[11]
_scheme.tif.png.webp)
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Nickel(II) bis(acetylacetonate) na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/5359853
- R. C. Mehrotra; R. Bohra; D. P. Gaur. Metal ß-Diketones and Allied Derivatives. [s.l.]: Academic Press, 1978. ISBN 0124881505.
- G. J. Bullen; R. Mason; P. Pauling. Octahedral Co-ordination of Nickel in Nickel(II) Bisacetylacetone. Nature. 1961, s. 291-292. DOI 10.1038/189291a0.
- G. J. Bullen; R. Mason; P. Pauling. The crystal and Molecular Structure of Bis(acetylacetonato)nickel (II). Inorganic Chemistry. 1965, s. 456-462. DOI 10.1021/ic50026a005.
- Šablona:Greenwood&Earnshaw2nd
- A. Döhring, R. Goddard, P. W. Jolly, C. Krüger, V. R. Polyakov, "Monomer-Trimer Isomerism in 3-Substituted Pentane-2,4-dione Derivatives of Nickel(II)", Inorganic Chemistry 1997, 36, 177-183. DOI:10.1021/ic960441c
- M. Kudrat-E-Zahan; Y. Nishida; H. Sakiyama. Identification of cis/trans isomers of bis(acetylacetonato)nickel(II) complexes in solution based on electronic spectra. Inorganica Chimica Acta. 2010, s. 168-172. DOI 10.1016/j.ica.2009.09.011.
- B. N. Figgis; M. A. Hitchman. Ligand Field Theory and its Application.Chybí název periodika! 2000.
- O. Metin; L. T. Yildirim; S. Ozkar. Synthesis, characterization and crystal structure of bis(acetylacetonato)dimethanolnickel(II). Inorganic Chemistry. 2007, s. 1121-1123. DOI 10.1016/j.inoche.2007.06.011.
- J. W. Wielandt; D. Ruckerbauer. Bis(1,5-cyclooctadiene)nickel(0). Inorganic Syntheses. 2010, s. 120. DOI 10.1002/9780470651568.ch6.
- Paul A. Williams, Anthony C. Jones, Jamie F. Bickley, Alexander Steiner, Hywel O. Davies, Timothy J. Leedham, Susan A. Impey, Joanne Garcia, Stephen Allen, Aline Rougier, Alexandra Blyr. Synthesis and Crystal Structures of Dimethylaminoethanol Adducts of Ni(II) Acetate and Ni(II) Acetylacetonate. Precursors for the Sol–Gel Deposition of Electrochromic Nickel Oxide Thin Films. Journal of Materials Chemistry. 2001, s. 2329-2334. DOI 10.1039/b103288g.
- Wilfried Kaschube; Klaus R. Pörschke; Günther Wilke. Tmeda-Nickel-Komplexe. Journal of Organometallic Chemistry. 1988, s. 525-532. DOI 10.1016/0022-328X(88)89050-8.
- Ruja Shrestha; Stephanie C. M. Dorn; Daniel J. Weix. Nickel-Catalyzed Reductive Conjugate Addition to Enones via Allylnickel Intermediates. Journal of the American Chemical Society. 2013-01-16, s. 751-762. DOI 10.1021/ja309176h. PMID 23270480.

