Teorie HSAB
HSAB je akronym pro "hard and soft (Lewis) acids and bases" (teorie tvrdých a měkkých, kyselin a zásad). Tato teorie bývá někdy nazývána Pearsonův koncept kyselin a zásad, fakticky ale jen rozšiřuje Lewisovu teorii kyselin a zásad. Teorie HSAB se hojně používá v chemii pro vysvětlení stability chemických sloučenin, rozpustnosti nebo reakčních mechanismů. Přívlastek "tvrdý" znamená, že daná částice je malá, má vysoký náboj (kritérium náboje se vztahuje zejména ke kyselinám, k zásadám jen v menší míře), a je slabě polarizovatelná. "Měkký" naopak znamená velký poloměr, malý náboj a velkou polarizaci.[1]
Teorii představil v roce 1963 americký chemik Ralph Pearson.
Teorie
Vlastnosti jednoatomových iontů
| vlastnost | HA | SA | HB | SB |
|---|---|---|---|---|
| elektronegativita | 0,7-1,6 | 1,9-2,5 | 2,1-3,0 | 3,4-4,0 |
| iontový poloměr [pm] | < 90 | > 90 | > 170 | ~ 120 |
| náboj | ≥ +3 | ≤ +2 |
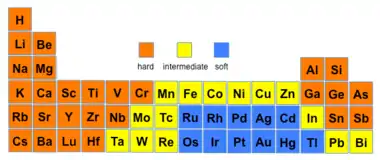
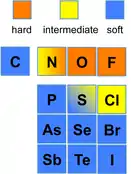
Molekulové orbitaly
Pearsonova teorie se doplňuje s teorií molekulových orbitalů, resp. HOMO/LUMO.
- Tvrdé Lewisovy kyseliny mají vysoko položený nejnižší neobsazený molekulový orbital (LUMO).
- Měkké Lewisovy kyseliny mají níže položený nejnižší neobsazený molekulový orbital (LUMO).
- Tvrdé Lewisovy zásady mají nízko položený nejvyšší obsazený molekulový orbital (HOMO).
- Měkké Lewisovy zásady mají výše položený nejvyšší obsazený molekulový orbital (HOMO).
Energetický rozdíl mezi HOMO/LUMO orbitalem je u komplexu složeného z SA a SB nižší, než u "tvrdých" analogů-
Příklady
- Tvrdé kyseliny (HA)
- H+
- kationty alkalických kovů (Li+,Na+,K+ ad.)
- Cr3+, Cr6+
- Ti4+
- BF3
- karbokation R3C+
- Měkké kyseliny (SA)
- Rtuťné a rtuťnaté ionty Hg2+, Hg22+, CH3Hg+
- Pt4+
- Pd2+
- Ag+
- BH3
- p-chloranil
- ryzí kovy (v oxidačním stavu 0)
- Tvrdé zásady (HB)
- OH−
- alkoxidový anion RO−
- malé halogenidové anionty (F−, Cl−)
- azan
- karboxylátový anion
- uhličitanový anion
- hydrazin
- Měkké zásady (SB)
- hydridový anion
- thiolátový anion
- jodidový anion
- fosfin
- thiokyanátový anion
- benzen
Důsledky na vlastnosti a aplikace
Sulfanová srážecí metody kvalitativní analýzy kationtů
Tradiční kvalitativní metoda analýzy kationtů je založena na rozpustnosti, resp. nerozpustnosti sulfidů kovů a jejich následných reakcích.
V prvním kroku (pro vysrážení kationtů I. třídy) se roztok sráží s roztokem kyseliny chlorovodíkové. Chloridový anion je tvrdší zásadou, než sulfidový anion (má menší poloměr) a vysráží proto tvrdší Lewisovy kyseliny (které by se srážely i se sulfanem; v prvním kroku je ale chceme oddělit, aby "nestínily" kationty II. třídy). Mezi tyto tvrdší kyseliny počítáme Ag+, Pb2+ Hg22+.
Sulfanová voda, s níž analyty následně reaguje, obsahuje sulfidový anion, který je měkkou zásadou (SB) a sráží proto kationty měkčí, než kationty I. třídy. Konkrétně jde o kationty Bi3+, Cd2+, Cu2+, Hg2+, As3+, As5+, Sb3+, Sb5+, Sn2+, Sn4+. Je zřejmé, že vyšší náboj znamená nižší tvrdost.
Od II. třídy tvrdost Lewisových kyselin stoupá, a to až k V. třídě kationtů, která zahrnuje Mg2+, Li+, Na+, K+ a NH4+. Zvláště kationty alkalických kovů platí za tvrdé kyseliny (HA), které jsou velmi dobře solvatovány vodou (hydratovány) a jejich soli jsou proto dobře rozpustné. Tyto ionty se rozlišují plamennými zkouškami.
Goldschmidtova geochemická klasifikace prvků
Švýcarsko-norský geochemik Victor Goldschmidt (1888-1947) publikoval v roce 1937 klasifikaci prvků periodické tabulky, které rozdělil na litofilní, siderofilní, chalkofilní a atmofilní[2].
Litofilní prvky vykazují silnou afinitu ke kyslíku, vyskytují se v silikátových minerálech, případně jako halogenidy. Litofilní prvky tedy tvoří kationty, které považujeme za tvrdé Lewisovy kyseliny (HA). Ty se vážou s kyslíkem jakožto π-donorem.
Chalkofilní prvky mají silnou afinitu k síře; tvoří s ní sulfidy. Oproti litofilním prvkům jsou jejich kationty měkčími kyselinami.
Pomocí konceptu HSAB můžeme vysvětlit, proč se vápník vyskytuje v litosféře jako síran nebo uhličitan (HA-HB, neboť anionty kyslíkatých solí obsahují atomy kyslíku sloužící jako donoři π-elektronů), olovo jako sulfid a zlato jako tellurid anebo ryzí (elementární zlato je nejměkčí kyselinou, což je dáno velikostí, elektronovou strukturou i nulovým nábojem).
Rozpustnost ve vodě
Voda rozpouští látky, které disponují alespoň jednou "tvrdou" částí. Například sulfid olovnatý není rozpustný ve vodě (sulfidový anion je měkčí zásadou než oxidový anion; olovnatý kation je měkkou Lewisovou kyselinou). Sulfid sodný ale rozpustný ve vodě je, protože sodný kation je tvrdou Lewisovou kyselinou, kterou voda dobře solvatuje.
Barevnost solí
Absorpce záření je u komplexů způsobena vnitřními elektronovými přechody o konkrétní energetické hodnotě. Pokud absorbovaná energie odpovídá vlnové délce v oblasti viditelné části spektra (380 až 770 nm), jsou komplexy barevné.
Sůl tvořená SA-SB je tmavší než její "tvrdý" analog. Příkladem může být oxid olovnatý PbO (SA-HB), respektive sulfid olovnatý. (SA-SB). Zatímco PbO je žluto-oranžová látky, PbS je černý.
Katalytické jedy
Jako katalyzátory se často užívají elementární kovy (platina, nikl ad.), tedy velmi měkké Lewisovy kyseliny (mají nulový náboj). Jako katalytické jedy proto fungují měkké Lewisovy zásady, např. sulfidy. Kovy s nimi zreagují.
Popis vazby mezi ligandy a centrální částicí v koordinační chemii
Teorie HSAB dobře popisuje výběr ligandů k centrálním částicím v komplexních (koordinačních) sloučeninách. Obecně platí, že centrální částice (atom přechodného kovu, případně jeho kation) je Lewisovou kyselinou a ligandy pak zásadami. Stabilní jsou takové komplexy, v nichž se váže tvrdá Lewisovou kyselina s tvrdou Lewisovou zásadou (a měkká s měkkou).
Chemická tvrdost
V roce 1983 Pearson společně s Robertem Parrem rozšířil dosud kvalitativně orientový koncept HSAB o kvantitativní aspekt prostřednictvím nové veličiny nazvané chemická tvrdost (η).[3] Chemická tvrdost je úměrná druhé derivaci celkové energie systému.
| Kyseliny | Zásady | ||||
|---|---|---|---|---|---|
| Kation vodíku | H+ | ∞ | Fluoridový anion | F− | 7,0 |
| Hlinitý kation | Al3+ | 45,8 | Azan | NH3 | 6,8 |
| Lithný kation | Li+ | 35,1 | Hydridový anion | H− | 6,8 |
| Skanditý kation | Sc3+ | 24,6 | Oxid uhelnatý | CO | 6,0 |
| Sodný kation | Na+ | 21,1 | Hydroxidový anion | OH− | 5,6 |
| Lanthanitý kation | La3+ | 15,4 | Kyanidový anion | CN− | 5,3 |
| Zinečnatý kation | Zn2+ | 10,8 | Fosfan | PH3 | 5,0 |
| Oxid uhličitý | CO2 | 10,8 | Dusitanový anion | NO2− | 4,5 |
| Oxid siřičitý | SO2 | 5,6 | Hydrogensulfidový anion | SH− | 4,1 |
| Jód | I2 | 3,4 | Methanidový anion | CH3− | 4,0 |
Reference
- Jolly, W. L. Modern Inorganic Chemistry. New York: McGraw-Hill, 1984. ISBN 0-07-032760-2. (anglicky)
- GOLDSCHMIDT, V. M. The principles of distribution of chemical elements in minerals and rocks. The seventh Hugo Müller Lecture, delivered before the Chemical Society on March 17th, 1937. J. Chem. Soc.. 1937-01-01, roč. 0, čís. 0, s. 655–673. Dostupné online [cit. 2017-10-16]. ISSN 0368-1769. DOI 10.1039/jr9370000655. (anglicky)
- PARR, Robert G.; PEARSON, Ralph G. Absolute hardness: companion parameter to absolute electronegativity. Journal of the American Chemical Society. 1983-12-01, roč. 105, čís. 26, s. 7512–7516. Dostupné online [cit. 2017-10-16]. ISSN 0002-7863. DOI 10.1021/ja00364a005.