Tyrozín
Tyrozín je aminokyselina, jedna z rozkladných kyselín produktov bielkovín.
| Názov chemikálie | Tyrozín |
| Skratky | Tyr Y |
| Chemický vzorec | C9H11N1O3 |
| Iné názvy | (S)-2-amino-3-(4-hydroxyfenyl)propionát |
| Molekulová hmotnosť | 181,2 g·mol−1 |
| Bod varu | |
| Hustota | |
| Izoelektrický bod | 5,66 |
| pKa | pKCOOH:2,20;pKNH2: 9,21;pK(fenol)=10,46 |
| CAS | 60-18-4 |
| EINECS číslo | |
 | |
Vlastnosti a štruktúra
Tyrozín patrí medzi neesenciálne, aromatické, glukogénne aj ketogénne aminokyseliny. Tyrozín je prekurzorom pre biosyntézu hormónov: adrenalínu, noradrenalínu, tyroxínu a trijódtyronínu, zároveň pre biosyntézu melanínov a neurotransmiterov – dopamínu a biochrómu.
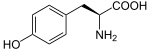
Tyrozín je organická, uhlíkatá molekula, ktorá obsahuje karboxylovú skupinu (-COOH) a aminoskupinu (-NH2). Podľa chemického charakteru postranného reťazca je tyrozín polárnou aminokyselinou. Polárny charakter dodáva tyrozínu fenolová skupina, vďaka svojej schopnosti tvoriť vodíkové väzby je súčasťou aktívnych centier bielkovín. Aromatický kruh tyrozínu funguje ako chromofor a absorbuje ultrafialové žiarenie v oblasti vlnových dĺžok 260 – 300 nm. Tyrozín obsahuje asymetrický atóm uhlíka, existuje preto v dvoch enantiomérnych konfiguraciach –D a –L, no v bielkovinách sa vyskytujú len L-formy.
Zdroj tyrozínu
Tyrozín nie je esenciálna aminokyselina, čo znamená, že telo ho v normálnom stave vytvára, ale iba vtedy ak je v tele dostatok fenylalanínu – prekurzor tyrozínu a enzýmov podieľajúcich sa na premene fenylalanínu na tyrozín. Táto reakcia nie je reverzibilná. Reakciu katalyzuje fenylalanínhydroxyláza (PAH). Komplex PAH predstavuje oxygenázu so zmiešanou funkciou a je prítomný v pečeni. Reakcia zahŕňa inkorportáciu jedného atómu molekulového kyslíka do para-polohy fenylalanínu, zatiaľ co druhý atóm kyslíka je redukovaný na vodu. Donorom vodíkov je tetrahydrobiopterín (THBP), ktorý sa regeneruje z dihydrobiopterínu (DHBP) na úkor NADH.
Prírodné zdroje tyrozínu sú: mandle, avokádo, banány, mliečne výrobky, lima fazule, jadierka a sezamové semená.
Priemyselne sa tyrozín vyrába biosyntézou využitím mikroorganizmov alebo chemickou syntézou a použitím rôznych biotechnologických postupov. Používa sa ako súčasť krmív pre úžitkové zvieratá, ochucovadlo potravin, konzervačné a antioxidačné prípravky.
Syntéza tyrozínu
- Tyrozín je syntetizovaný hydroxyláciou fenylalanínu za katalýzy fenylalanínhydroxylázy. (pozri vyššie).
- Syntéza tyrozínu je spoločná pre všetky aromatické aminokyseliny. Biosyntéza aromatických aminokyselín začína kondenzáciou fosfoenolpyruvátu (medziprodukt glykolýzy) a erytróza-4-fosfátu (medziprodukt regeneračnej fázy pentózového cyklu). Ďalej cez mnoho medziproduktov vzniká šikimát, ktorý reaguje s ďalším fosfoenolpyruvátom na chorizmát. Tu sa cesta biosyntézy aromatických aminokyselín vetví.
Metabolizmus, odbúravanie tyrozínu
Tyrozín sa môže metabolizovať rôznými cestami:
- vznik fumarátu a acetacetátu
- vznik dopamínu, adrenalínu a noradrenalínu
- vznik melanínov
- vznik hormónov štítnej žľazy- tyroxín a trijódtyronín
Vznik fumarátu a acetacetátu
Tyrozín je transaminovaný na 4-hydroxyfenylpyruvát za účinku 2.aminotransferázy. Prešmykom bočného reťazca do o-polohy, oxidačnou dekarboxyláciou a hydroxyláciou sa premieňa na homogentizát pôsobením p-hydroxyfenylpyruvátdioxygenázy. Homogentizát sa pôsobením homogentizátdioxygenázy cez maleylacetát oxiduje na fumarylacetát za účinku maleylacetacetátizomerázy. Fumarylacetát sa pôsobením fumarylacetoacetázy hydrolytický štiepi na fumarát a acetacetát.
Vznik dopamínu a katecholamínov
Tyrozín sa účinkom tyrozínhydroxylázy premieňa na DOPA-3,4-dihydroxyfenylalanín. Účinkom DOPA-dekarboxylázy vzniká dopamín. Hydroxyláciou dopamínu účinkom dopamínmonooxygenázy vzniká noradrenalín. Pre túto reakciu je potrebný askorbát a molekulový kyslík, z reakcie sa uvoľňuje voda a dehydroaskorbát. Metyláciou noradrenalínu za účasti N-metyltransferázy a S-adenozylmetionínu vzniká adrenalín.
Katecholamíny sú syntetizované v chromafinních bunkách v dreni nadobličiek a majú funkciu hormónov. Okrem drene nadobličiek sú syntetizované aj v nervových bunkách (dopamínergné neuróny a postgangliové sympapatikové neuróny) a majú charakter neurotransmiterov. Syntéza katecholamínov je regulovaná nervovými impulzmi. Pri akútnom strese sa syntéza katecholamínov rýchlo zvyšuje, ich syntézu zvyšuje aj pôsobenia sympatika. Označujú sa aj ako stresové hormóny.
Účinky katecholamínov závisia hlavne na type receptora. Rozoznávame adrenergné receptory alfa a beta typov a v niekoľkých subtypoch. Katecholamíny pôsobia hlavne na metabolizmus glukózy (aktiváciou fosforylázy zvyšujú glykogenolýzu). Okrem glukózy pôsobia aj na metabolizmus lipidov, tým že aktivujú hormón-senzitívnu lipázu zvyšujú štiepenie tukov. Pri zvýšenom vylučovaní katecholamínov sa objavuje hypertenzia, hyperglykémia a glykozúria, zvýšenie koncentrácie neesterifikovaných mastných kyselín a vysoká močová exkrécia kyseliny vanilmandľovej. Katecholamíny produkované neurónmi pôsobia parakrinne, t. j. pôsobia na susedné bunky, majú teda charakter neurotransmiterov.
Vznik melanínov
Tyrozín sa oxiduje tyrozinázou s O2 na DOPA. DOPA sa dehydrogenuje, čím vzniká dopachinón. Ďalšie reakcie prebiehajú neenzýmovo vedú k indolchinónu (indol-5,6-chinón) cez viacero medziproduktov. Jeho polymerizáciou vzniká hnedočierny eumelanín. Eumelanín je pigment nachádzajúci sa vo vlasoch, očiach a koži. Dopachinón však môže tiež adovať skupiny –SH cysteínu a tak sa oxidovať na polymérne chinóny. Touto cestou vzniká žltý feomelanín.
Funkcia: predstavujú biologickú ochranu proti UV-žiareniu slnečného svetla.
Genetické poruchy v tvorbe pigmentov sa označujú ako albinizmus. Základom vzniku týchto ochorení je porucha transportu tyrozínu cez bunkovú membránu alebo prítomnosťou defektných enzýmov podieľajúcich sa na premene tyrozínu na melaníny.
Vznik tyroxínu a trijódtyronínu
Tyrozín je súčasťou tyreoglobulínu (bielkovina nachadzajúca sa v štítnej žľaze). Účinkom jodidovej pumpy sa jód dostáva do štítnej žľazy. Účinkom jodperoxidázy sa jód oxiduje a viaže sa na tyrozylové zvyšky tyreoglobulínu. Týmto naviazaním vzniká monojódtyrozín a dijódtyrozín. Tyroxín vzniká kondenzáciou dvoch molekúl dijódtyrozínu. Trijódtyronín vzniká kondenzáciou jednej molekuly monojódtyrozínu a dijodtyrozínu. Tieto hormóny sa postupne uvoľňujú z tyreoglobulínu do krvného riečiska.
Hormóny štítnej žľazy majú mnohotvárny účinok, vo všeobecnosti platí, že urýchľujú reakcie prebiehajúce v bunke. To je spojené s vyššou spotrebou kyslíka a živín, no i s tvorbou tepla. Pôsobia na metabolizmus sacharidov, lipidov a aminokyselín. Účinok hormónov na metabolizmus sacharidov sa prejaví zvýšenou resorpciou glukózy z čreva, poklesom zásobného glykogénu a zníženou produkciou inzulínu. Tieto procesy vedú k hyperglykémii. V metabolizme lipidov hormóny urýchľujú lipolýzu, čím sa hladina lipidov a cholesterolu v krvi znižuje. Tieto hormóny podporujú proteosyntézu. Ich produkcia je nevyhnutná pre rast a dozrievanie kostí a pre normálny vývoj mozgu.
Poruchy metabolizmu tyrozínu
Medzi najčastejšie poruchy metabolizmu tyrozínu patrí:
- Tyrozinémia (typ I, typ II)
- Neonatálna tranzitórna tyrozinémia
- Alkaptonúria
- Hawkinsinúria
- Parkinsonova choroba
Tyrozinémia typ I (tyrozinóza)
Biochemická porucha: Pravdepodobný defekt je v neprítomnosti alebo silno zníženej aktivite fumarylacetacetáthydroxylázy a možno tiež v maleinylacetacetáthydrolázy, čo sa prejaví zvyšenou koncentráciou tyrozínu v plazme (6 – 12 mg/100 ml = 60 – 120 mg/l), podobne je v krvi zvyšená aj hodnota methionínu.
Klinický obraz: Priebeh ochorenia môže byť akútny alebo chronický. Pri akútnej tyrozinóze kojencov pozorujeme zvracanie, zápach. Pokiaľ nie sú liečení, zomierajú už počas 6 – 8 mesiaca na zlyhanie pečene. Pri chronickej forme sa vyvíja ťažká pečeňová cirhóza. Časté sú hepatómy. Na obličkách sa vyskytujú poruchy proximálnych tubulov so zníženou spätnou resorpciou glukózy, fosfátov a aminokyselín. V určitých prípadoch boli pozorované aj poruchy duševného vývoja, hyperpigmentácia kože, hypertenzia (spôsobená zvýšenou tvorbou katecholamínov) a hyperglykémia v dôsledku hyperplázie buniek Langerhansových ostrovčekov pankreasu. Chorí spravidla zomierajú vo veku 10 rokov.
Terapia: Tyrozinémia typu I je genetické ochorenie, ktoré sa dedí autozómovo recesívne. Preto sa poruchy pečene a obličiek nedajú úplne odstrániť. Príznaky sa však dajú zmierniť stravou chudobnou na tyrozín a fenylalanín.
Tyrozinémia typ II (Richner-Hanhartov syndróm)
Biochemická porucha: Defekt spočíva v poruche cytosolovej pečeňovej tyrozínaminotransferázy, mitichondriálny izoenzým má naopak normálnu aktivitu. Defekt enzýmu sa prejaví zvýšenou hladinou tyrozínu v plazme (4 – 5 mg/100 ml = 40 – 50 mg/l) a zvýšenou hladinou v moči. Tyrozín je jedinou aminokyselinou, ktorá je v moči zvýšená.
Klinický obraz: Klinický obraz charakterizujú mnohopočetné malformácie (mikrocefália, zmeny na rohovke), erytém, hyperkeratosis palmarum et plantarum a taktiež porucha duševného vývoja. Je pozoruhodné, že nepozorujeme zmeny v pečeni a v obličkách aj keď je hladina tyrozínu vysoká.
Terapia: Terapia spočíva v zníženom prísune aromatických aminokyselín a proteínov. Táto diéta vedie k normalizácii hladiny tyrozínu a tyrozínových metabolitov v plazme a v moči. Pri skorom začatí liečby zabraní zmenám na očiach a na koži. Ochorenie je dedičné, dedí sa autozómovo recesívne.
Novorodenecká, tranzitorná hypertyrozinémia
Biochemická porucha: Biochemickou príčinou tejto anomálie je oneskorené zrenie 4-hydroxyfenylpyruvátdioxygenázy. Aktivita tohto enzýmu narastá normálne na konci fetalného vývoja tým, že sa zvyšuje jeho biosyntéza. Ďalšie faktory ktoré ovplyvňujú predlženú hypertyrozinémiu u novorodencov je vysoký obsah tyrozínu v mliečnej strave a nedostatok vitamínu C. Z nadbytku prijatého tyrozínu sa tvorí hydroxyfenylpyruvát, ktorý rovnako ako nedostatok vitamínu C, inhibuje enzým vo fetálnej pečeni.
Terapia: Hypertyrozinémia novorodencov sa hodnotí ako neškodná a spravidla mizne spontánne počas prvých týždňov života hneď ako sa zníži prísun proteínov a po vysokých dávkach vitamínu C.
Ochorenie pozorujeme u 30% nedonosených detí a u 10% normálnych novorodencov.
Alkaptonúria
Biochemická porucha: Metabolickou príčinou alkaptonúrie je nedostatok homogentizátdioxygenázy, ktorá štiepi homogentizát.
Klinický obraz: Homogentizát, ktorý sa vylučuje v moči, je následne oxidovaný vzdušným kyslíkom na hnedo- čierny pigment- alkapton. Ďalším príznakom v neskoršom veku je ochronóza – pigmentácia spojivových tkanív (chrupiek). Mechanizmus vzniku ochronózy spočíva v oxidácii honogentizátu polyfenoloxidázou za vzniku benzochinónacetátu, ktorý polymerizuje a viaže sa na makromolekuly spojivových tkanív.
Terapia: Alkaptonúria je dedične ochorenie, dedí sa autozómovo recesívne (chromozóm 9p, incidencia 1:250 000). Toto ochorenie sa nedá vyliečiť, môžeme však zmierniť príznaky ochorenia. Pacientom sa odporúča čiastočné obmedzenie bielkovín bohatých na fenylalanín a tyrozín a režim dňa a zamestnanie šetriace postihované kĺby vrátane chrbtice. Z ďalších liečebných možností prichádza do úvahy náhradne dodávanie normálneho enzýmu v purifikovanej a upravenej forme a perspektívne aj somatická génová terapia.
Hawkinsinúria
Biochemická porucha: Vzácna porucha metabolizmu spôsobená deficienciou enzýmového komplexu-hydroxyfenylpyruvátdioxygenázy. Dôsledkom je akumulácia metabolitu epoxidu s následným vylučovaním v moči. Manifestuje sa v detstve po zvýšenej kalorickej záťaži acidózou, hepatomegaliou.
Terapia: Stav sa upravuje pri zníženom prísune fenylalanínu a tyrozínu. Toto je ochorenie je dedičné, dedí sa autozómovo dominantne.
Parkinsonova choroba
Biochemická porucha: Podstatou je porucha metabolizmu niektorých látok v mozgu a to nedostatok dopamínu v bazálnych gangliách a relatívna prevaha acetylcholínu. Dopamín sa tvorí predovšetkým v substancia nigra v strednom mozgu. U zdravého človeka zaniká ročne asi 6 % dopaminergných neurónov, ale u parkinsonikov je tento proces urýchlený. Klinické prejavy sa objavia až vtedy, keď pôvodne množstvo neurónov klesne pod 20 % pôvodnej úrovne.
Klinický obraz: Nedostatok dopamínu vedie k poruche pohybu – zmenená chôdza s nebezpečím pádu, svalovej stuhnutosti a traseniu. V neskorších štádiach vznikajú aj poruchy reči a objavujú sa aj vegetatívne príznaky ako zápcha, poruchy spánku. Okrem neurologického postihnutia môže byť prítomná podkôrová demencia, spomalenie psychických procesov a depresia. Zvyčajne je to ochorenie pozorované u starších osôb medzi 65 – 90 rokom.
Terapia: parkinsonovu chorobu zatiaľ nevieme úplne vyliečiť, liečia sa len jej príznaky. Využíva sa farmakologická liečba zahŕňajúca levadopu, chirurgický zákrok, ktorý sa používa len v ťažkých prípadoch. Dôležitá je aj doplnková liečba zahŕňajúca vzdelávanie, poradenstvo, liečbu rečových porúch, fyzioterapiu a terapiu prácou.