Glycín
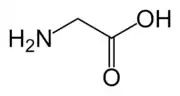
Glycín, C2H5NO2 (Gly, G) je aminokyselina s nepolárnym postranným reťazcom. Na rozdiel od ostatných nepolárnych aminokyselín (Ala, Val, Leu, Ile, Pro, Met, Phe, Trp) jej celkový charakter však nie je príliš nepolárny. Ide o najjednoduchšiu z 22 proteínogénnych (kódovaných) aminokyselín.
| Glycín | ||||||||||||||||||||
 Glycín | ||||||||||||||||||||
 Glycín | ||||||||||||||||||||
| Všeobecné vlastnosti | ||||||||||||||||||||
| Sumárny vzorec | C2H5NO2 | |||||||||||||||||||
| Vzhľad | biela pevná látka | |||||||||||||||||||
| Fyzikálne vlastnosti | ||||||||||||||||||||
| Molekulová hmotnosť | 75,1 u | |||||||||||||||||||
| Molárna hmotnosť | 75,07 g/mol | |||||||||||||||||||
| Teplota rozkladu | 232 – 236 °C | |||||||||||||||||||
| Hustota | 1,607 g/cm³ | |||||||||||||||||||
| ||||||||||||||||||||
| Ďalšie informácie | ||||||||||||||||||||
| Číslo CAS | 56-40-6 | |||||||||||||||||||
| EINECS číslo | 200-272-2 | |||||||||||||||||||
| Číslo RTECS | MB7600000 | |||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | ||||||||||||||||||||
Glycín ako jediná biogénna aminokyselina nie je opticky aktívna: kvôli prítomnosti dvoch vodíkov na α-uhlíku má rovinu symetrie (nemôže sa teda rozlíšiť D-a L-glycín). Z dôvodu krátkeho bočného reťazca sa môže glycín viazať na miesta, na ktoré iné aminokyseliny zo sterických dôvodov nemôžu. Napríklad iba glycín môže byť vnútornou aminokyselinou kolagénnej závitnice.
Glycín je evolučne veľmi stabilný na dôležitých miestach niektorých proteínov (napríklad, v cytochróme c, myoglobíne, a hemoglobíne), pretože mutácie meniace túto aminokyselinu za inú s väčším bočným reťazcom výrazne menia štruktúru proteínu. Ďalším príkladom je aktívne centrum proteázy chymotrypsínu, ktorá štiepi enzýmy za objemnejšími aminokyselinami typu fenylalanín, tryptofán, tyrozín, a preto aj tu má zámena glycínu vážne dôsledky. Enzým neschopný katalýzy je vyradený z činnosti v proteazóme.
Glycín má rovnaký sumárny vzorec ako nitroetán. Väčšina proteínov obsahuje iba malé množstvo glycínu. Dôležitou výnimkou je kolagén, ktorý sa z jednej tretiny skladá z glycínu. Dôvod spočíva v tom, že ďalšiu približne tretinu kolagénneho vlákna zaujíma lyzín a hydroxylyzín. Obe tieto aminokyseliny majú obmedzené možnosti rotácie a glycín tak vyrovnáva deformačné vplyvy týchto aminokyselín na štruktúru kolagénového vlákna. Vo veľkom množstve sa glycín nachádza aj v elastíne.
Kódujú ho kodóny GGU, GGC, GGA a GGG.
Fyziologické účinky
Glycín je inhibičný neuroprenášač v CNS, obzvlášť v mieche, mozgovom kmeni a v sietnici. Aktiváciou glycínových iónotropných receptorov na postsynaptickej membráne sa otvárajú iónové kanály a chloridové ióny vstupujú do neurónu, čo pôsobí hyperpolarizáciu a tzv. inhibičný postsynaptický potenciál (IPSP). Strychnín je antagonista inotropných glycínových receptorov. Glycín je spoločne s glutamátom ligandom NMDA receptorov. Na rozdiel od inhibičných účinkov v mieche, na NMDA glutamínergných receptoroch má glycín účinky excitačné. LD50 glycínu je 7930 mg/kg pre potkana (orálne) a smrť je spôsobená hyperexcitabilitou nervovej sústavy.
Biosyntéza
Glycín nie je esenciálna aminokyselina, čo znamená, že telo si je schopné syntetizovať jej potrebné množstvo samo bez nutnosti jej prísunu v potrave. Biosyntéza prebieha z aminokyseliny serín, ktorá je vyrábaná z 3-fosfoglycerátu. U väčšiny organizmov túto reakciu katalyzuje enzým serínhydroxymetyltransferáza s pomocou kofaktoru pyridoxalfosfátu (pyridoxal je druh vitamínu B6):[1]
- serín + tetrahydrofolát → glycín + 5,10-metyléntetrahydrofolát + H2O
V pečeni stavovcov je syntéza glycínu katalyzovaná enzýmom glycínsyntáza (alebo GDC – komplex glycíndekarboxylázy). Táto reakcia je reverzibilná:[1]
- CO2 + NH4+ + 5,10-metyléntetrahydrofolát + NADH + H+ → Glycine + tetrahydrofolát + NAD+
Degradácia
Glycín je degradovaný tromi rôznymi cestami. V živočíchoch prevažuje cesta cez enzým glycíndekarboxyláza (rovnaký enzým ako ten, ktorý sa zúčastňuje sa biosyntéze). Táto cesta je spätná reakcia biosyntézy:[1]
- Glycín + tetrahydrofolát + NAD+ → CO2 + NH4+ + 5,10-metyléntetrahydrofolát + NADH + H+
Druhá cesta je dvojkroková. Prvý krok je spätná reakcia biosyntézy zo serínu enzýmom serínhydroxymetyltransferáza. Serín je potom premenený na pyruvát enzýmom seríndehydratáza.[1] V tretej ceste je glycín premenený na glyoxylát pomocou D-aminokyselina oxidázy. Glyoxylát je potom oxidovaný pečeňovou laktátdehydrogenázou na oxalát v NAD+-závislej reakcii.[1]
Prítomnosť v medzihviezdnom priestore
V roku 1994 skupina astronómov z Illinoiskej univerzity v Urbana-Champaign, vedenej Lewisom Snyderom, ohlásila objav molekúl glycínu vo vesmírnom priestore. Nasledujúcimi analýzami sa ukázalo, že tento objav nemôže byť potvrdený. O deväť rokov neskôr, v 2003, Yi-Jehng Kuan z National Taiwan Normal University a Steve Charnley detegovali medzihviezdny glycín v troch zdrojoch medzihviezdnej hmoty. Ohlásili identifikáciu 27 spektrálnych čiar glycínu pomocou rádioteleskopu. Podľa počítačových simulácií a laboratórnych experimentov vznikol glycín pravdepodobne tak, že ľadové častice obsahujúce jednoduché organické molekuly boli vystavené ultrafialovému žiareniu. V októbri 2004, Snyder a spolupracovníci znovu preskúmali Kuanov objav glycínu. Snyder dokázal, že glycín nebol ani v jednom z troch zdrojov správne detegovaný.
Referencie
- NELSON, David L; COX, Michael M.. Principles of Biochemistry. Zväzok 4. New York : W. H. Freeman, 2005. ISBN 0-7167-4339-6. S. 127, 675–77, 844, 854.
Literatúra
- Kuan YJ, Charnley SB, Huang HC, et al. (2003) Interstellar Glycine. ASTROPHYS J 593 (2): 848-867
- Snyder LE, Lovas FJ, Hollis JM, et al. (2005) A rigorous attempt to Verify interstellar Glycine. ASTROPHYS J 619 (2): 914-930
- Safety (MSDS) data for glycine, 2005, The Physical and Theoretical Chemistry Laboratory Oxford University
- Dawson, RMC, Elliott, DC, Elliott, WH, and Jones, KM, Data for Biochemical Research (3rd edition), pp. 1-31 (1986)
Externé odkazy
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Glycin na českej Wikipédii.
| Chemický portál Biologický portál |