Chlorid meďnatý
Chlorid meďnatý (CuCl2) je anorganická zlúčenina. Ide o žltohnedú tuhú látku, ktorá pomaly pohlcuje vlhkosť a tvorí modrozelený dihydrát. Chlorid meďnatý je druhou najrozšírenejšou meďnatou zlúčeninou po sírane meďnatom.
| Chlorid meďnatý | |||||||||||||||||||||||||||||||||||||
_chloride.jpg.webp) Chlorid meďnatý | |||||||||||||||||||||||||||||||||||||
 Chlorid meďnatý | |||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||
| Sumárny vzorec | CuCl2 | ||||||||||||||||||||||||||||||||||||
| Vzhľad | žltohnedá práškovitá látka (bezvodný) modrozelená kryštalická látka (dihydrát) | ||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 134,5 u (bezvodný) 170,5 u (dihydrát) | ||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 134,452 g/mol (bezvodný) 170,483 g/mol (dihydrát) | ||||||||||||||||||||||||||||||||||||
| Teplota topenia | 620 °C 110 °C (dehydratácia dihydrátu) | ||||||||||||||||||||||||||||||||||||
| Teplota rozkladu | 993 °C | ||||||||||||||||||||||||||||||||||||
| Hustota | 3,386 g/cm³ (bezvodný) 2,51 g/cm³ (dihydrát) | ||||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: bezvodný 69,2 g/100 ml (0 °C) 71,5 g/100 ml (10 °C) 74,5 g/100 ml (20 °C) 76,4 g/100 ml (25 °C) 78,3 g/100 ml (30 °C) 81,8 g/100 ml (40 °C) 85,5 g/100 ml (50 °C) 89,4 g/100 ml (60 °C) 8,0 g/100 ml (80 °C) 110,5 g/100 ml (100 °C) dihydrát 110,27 g/100 ml (0 °C) 117,58 g/100 ml (20 °C) 149,39 g/100 ml (60 °C) 201,67 g/100 ml (100 °C) v polárnych rozpúšťadlách: metanol 56,5 g/100 ml (0 °C) 58,6 g/100 ml (20 °C) 61,8 g/100 ml (40 °C) 66,4 g/100 ml (60 °C) etanol 43,3 g/100 ml (0 °C) 50,0 g/100 ml (20 °C) 58,3 g/100 ml (40 °C) 70,8 g/100 ml (60 °C) kyselina octová glycerol acetón dietyléter v nepolárnych rozpúšťadlách: pyridín | ||||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||||
| Entropia rozpúšťania | −385 J/g | ||||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −215,8 kJ/mol (bezvodný) −818,6 kJ/mol (dihydrát) | ||||||||||||||||||||||||||||||||||||
| Štandardná entropia | 108 J K−1 mol−1 (bezvodný) 190,6 J K−1 mol−1 (dihydrát) | ||||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | −171,4 kJ/mol (bezvodný) −660,8 kJ/mol (dihydrát) | ||||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,534 6 J K−1 g−1 | ||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||
| Číslo CAS | 7447-39-4 (bezvodný) 10125-13-0 (dihydrát) | ||||||||||||||||||||||||||||||||||||
| Číslo UN | 2802 | ||||||||||||||||||||||||||||||||||||
| EINECS číslo | 231-210-2 | ||||||||||||||||||||||||||||||||||||
| Číslo RTECS | GL7000000 | ||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||
Štruktúra
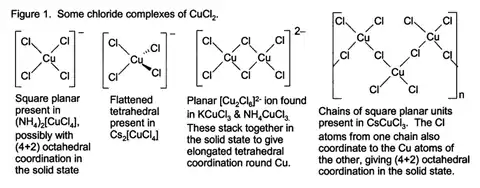
Bezvodý chlorid meďnatý má štruktúru vychádzajúce z tej, ktorú poznáme od jodidu kademnatého. Meďnaté centrá sú osemstenné. Väčšina meďnatých zlúčenín vykazuje deformácie oproti ideálnej osemstennej geometrii vplyvom Jahn-Tellerovho efektu, ktorý tu popisuje lokalizáciu jedného elektrónu d v orbitále, kde je silne antiväzobný oproti páru chloridových ligandov. V dyhidráte chloridu meďnatého má meď opäť silne zdeformovanú osemstennú geometriu; centra medi sú obklopené dvoma ligandami vody a štyrmi chloridovými, ktoré asymetricky premosťujú meďnaté centrá.[1]
Chlorid meďnatý je paramagnetický. V histórii bol dyhidrát chloridu meďnatého použitý pre prvé meranie elektrónovej paramagnetickej rezonancie, a to Jevgenijom Zavojskijim v roku 1944. [2] [3]
Vlastnosti a reakcie

Vodné roztoky pripravované z chloridu meďnatého obsahujú škálu meďnatých komplexov v závislosti na koncentrácii, teplote a prítomnosti ďalších chloridových iónov. Táto škála siaha od modrej farby [Cu(H2O)6]2+ až po žltú alebo červenú farbu halogenidových komplexov so vzorcom [CuCl2+x]x-.[4]
chloride_crystal_01.jpg.webp)
Pri 1 000 °C sa chlorid meďnatý rozkladá na chlorid meďný a chlór:
- 2 CuCl2 → 2 CuCl + Cl2
S chlorovodíkom alebo inými zdrojmi chloridu tvorí komplexné ióny: červený CuCl3- alebo žltý CuCl42-.[5]
- CuCl2 + 2 Cl- ↔ CuCl3- + Cl- ↔ CuCl42-
Niektoré z týchto komplexov môžu kryštalizovať z vodných roztokov a získavajú širokú škálu rôznych štruktúr.
Pri pridaní hydroxidu sodného do roztoku chloridu meďnatého sa zráža hydroxid meďnatý:
- CuCl2 + 2 NaOH → Cu(OH)2 + 2 NaCl
Chlorid meďnatý tvorí tiež rôzne koordinačné komplexy s ligandmi, napríklad s pyridínom alebo trifenylfosfánoxidom:
- CuCl2 + 2 C5H5N → [CuCl2(C5H5N)2] (štvorstenný)
- CuCl2 + 2 (C6H5)3P=O → [CuCl2((C6H5)3P=O)2] (štvorstenný)
Pravdaže niektoré „mäkké ligandy“, napríklad fosfánové (napr. trifenylfosfán), jodidové alebo kyanidové, rovnako ako napríklad niektoré terciárne amíny, spôsobujú redukciu na meďnatý komplex. Pre prevod chloridu meďnatého na medné deriváty je ale všeobecne bežnejšie redukovať vodný roztok oxidom siričitým:
- 2 CuCl2 + SO2 + 2 H2O → 2 CuCl + 2 HCl + H2SO4
Hydrolýzou chloridu meďnatého vzniká oxychlorid meďnatý, Cu2Cl(OH)3, ktorý je populárnym fungicídom.
Príprava
Chlorid meďnatý sa komerčne pripravuje chloráciou medi:
- Cu + Cl2 + 2 H2O → CuCl2.(H2O)2
Možno ho vyrábať aj z hydroxidu, oxidu alebo uhličitanu meďnatého pôsobením kyseliny chlorovodíkovej. Elektrolýzou vodného roztoku chloridu sodného s medenými elektródami vzniká (okrem iného) modrozelená pena, ktorú je možné zbierať a prevádzať na hydrát chloridu meďnatého.
Bezvodý chlorid meďnatý je možné pripravovať priamo zlučovaním prvkov, teda medi a chlóru.
Chlorid meďnatý je možné čistiť kryštalizáciou z horúcej zriedenej kyseliny chlorovodíkovej, ochladzovaním v kúpeli chloridu vápenatého a ľadu.[6][7]
Výskyt v prírode
Chlorid meďnatý sa v prírode vyskytuje ako veľmi vzácny minerál tolbachit a v podobe dihydrátu ako eriochalcit. Oba sa objavujú blízko fumarolu. Rozšírenejšie sú zmiešané oxyhydroxid-chloridy, napríklad atacamit Cu2(OH)3Cl, objavujúce sa v oxidačných zónach slojov medenej rudy za suchého podnebia (tiež v niektorých pozmenených usadeninách).
Použitie
Kokatalyzátor vo Wackerovom procese
Hlavnou priemyselnou aplikáciou chloridu meďnatého je jeho použitie ako kokatalyzátora (spolu s chloridom paládnatým) vo Wackerovom procese. Tu sa etylén prevádza na etanál (acetaldehyd) pomocou vody a vzduchu. Pri reakcii sa chlorid paládnatý redukuje na elementárne paládium, chlorid meďnatý ho oxiduje späť na chlorid paládnatý. Vzduch potom oxiduje výsledný chlorid meďný späť na chlorid meďnatý, čím sa cyklus uzavrie.
- C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2 HCl
- Pd + 2 CuCl2 → 2 CuCl + PdCl2
- 4 CuCl + 4 HCl + O2 → 4 CuCl2 + 2 H2O
Celý proces možno zapísať takto:
- 2 C2H4 + O2 → 2 CH3CHO
Chlorácia
Chlorid meďnatý katalyzuje chloráciu pri výrobe vinylchloridu a dichlóretánu.[8]
Ďalšie aplikácie v organickej syntéze
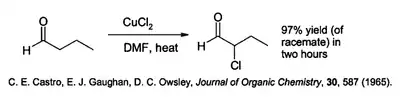
Chlorid meďnatý má množstvo rôznych špecializovaných aplikácií v syntéze organických zlúčenín.[6] Chlóruje aromatické uhľovodíky – často za prítomnosti oxidu hlinitého. Je schopný chlórovať alfapozíciu karbonylových zlúčenín:[9]
Táto reakcia prebieha v polárnych rozpúšťadlách, napríklad dimetylformamide (DMF), často v prítomnosti chloridu lítneho, ktorý reakciu urýchľuje.
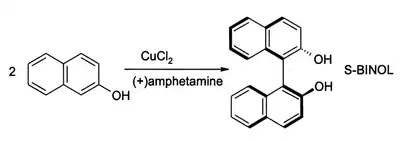
Za prítomnosti kyslíka môže chlorid meďnatý oxidovať fenoly. Takto možno získavať chinóny alebo spriahnuté produkty oxidatívnej dimerizácie. Druhý z procesov poskytuje (s veľkou výťažnosťou)1,1’-bi-2-naftol (BINOL):[10]
Takéto zlúčeniny sú surovinami pre syntézu 2,2'-bis(difenylfosfino)-1,1'-binaftylu (BINAP) a jeho derivátov.
Dihydrát chloridu meďnatého vyvoláva hydrolýzu acetonidu, t. j. deprotekciu k regenerácii diolov[11] alebo aminoalkoholov, ako v tomto príklade (kde TBDPS = terc-butyldifenylchlórsilán):[12]
Pyrotechnika
Chlorid meďnatý možno použiť v pyrotechnike na farbenie plameňa na modrozeleno (podobne ako ďalšie zlúčeniny medi).
Podobné látky
- Bromid meďnatý
- Fluorid meďnatý
- Chlorid meďný
- Chlorid strieborný
- Chlorid zlatitý
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chlorid měďnatý na českej Wikipédii.
Referencie
- Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- BALÁŽ, Peter. Mechanochemistry in Nanoscience and Minerals Engineering. [s.l.] : Springer, 2008. Dostupné online. ISBN 3-540-74854-7. S. 167.
- BRUSTOLON, Marina. Electron paramagnetic resonance: a practitioner's toolkit. [s.l.] : John Wiley and Sons, 2009. Dostupné online. ISBN 0-470-25882-9. S. 3.
- Greenwood, N. N. and Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Naida S. Gill et al.. Inorganic Syntheses. Inorganic Syntheses, 1967, roč. 9, s. 136–142. DOI: 10.1002/9780470132401.ch37.
- S. H. Bertz, E. H. Fairchild, in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 220-3, Wiley, New York, 1999.
- W. L. F. Armarego; Christina Li Lin Chai. Purification of Laboratory Chemicals. 6th. vyd. [s.l.] : Butterworth-Heinemann, 2009-05-22. Dostupné online. ISBN 1-85617-567-7. S. 461.
- H.Wayne Richardson, „Copper Compounds“ in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim, DOI:10.1002/14356007.a07_567
- C. E. Castro; E. J. Gaughan; D. C. Owsley. Cupric Halide Halogenations. Journal of Organic Chemistry, 1965, čís. 30, s. 587. Téma 2. DOI: 10.1021/jo01013a069.
- J. Brussee; J. L. G. Groenendijk; J. M. Koppele, A. C. A. Jansen. On the mechanism of the formation of s(−)-(1, 1'-binaphthalene)-2,2'-diol via copper(II)amine complexes. Tetrahedron, 1985, čís. 41, s. 3313. Vyd. 16. DOI: 10.1016/S0040-4020(01)96682-7.
- Chandrasekhar, M., Chandra, Kusum L; Singh, Vinod K. Total Synthesis of (+)-Boronolide, (+)-Deacetylboronolide, and (+)-Dideacetylboronolide. Journal of Organic Chemistry, 2003, čís. 68, s. 4039–4045. DOI: 10.1021/jo0269058. PMID 12737588.
- KRISHNA, Palakodety Radha, Dayaker, G. A stereoselective total synthesis of (-)-andrachcinidine via an olefin cross-metathesis protocol. Tetrahedron Letters (Elsevier), 2007, čís. 48, s. 7279–7282. DOI: 10.1016/j.tetlet.2007.08.053.
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.