Orbitál
Orbitál (iné názvy: orbita, staršie orbit, atómový orbit(ál)/atómová orbita) je priestor, v ktorom sa vyskytuje elektrón v atóme. Podľa súčasných poznatkov možnosť výskytu elektrónu v danom priestore nemožno vypočítať s ľubovoľne vysokou presnosťou. Elektrónový orbitál predstavuje určitý kvantový stav individuálneho elektrónu v elektrónovom oblaku okolo jadra atómu.
Tento pojem nie je možné vysvetliť pomocou klasickej predstavy o štruktúre atómu, kedy okolo atómového jadra obiehajú elektróny podobne ako planéty okolo Slnka. Elektrón ako elementárna častica vykazuje vlastnosti, ktoré zodpovedajú časticiam aj vlneniu. V dôsledku Heisenbergovho princípu neurčitosti nie je možné presne stanoviť polohu elektrónu v atóme v danom časovom okamihu, preto je potrebné na opis použiť pravdepodobnosť. Atómový orbitál je opísaný vlnovou funkciou elektrónu v elektrickom poli kladne nabitého jadra, ktorá je riešením Schrödingerovej rovnice. Orbitál ohraničuje oblasť, kde je najvyššia pravdepodobnosť výskytu daného elektrónu.
Označovanie orbitálov
Orbitály sa označujú podľa všeobecného vzorca
- X typy
kde X zodpovedá energii orbitálu (hlavné kvantové číslo elektrónu n). Typ orbitálu sa značí malým písmenom a popisuje tvar orbitálu, zodpovedá momentu hybnosti (vedľajšiemu kvantovému číslu l) a y je počet elektrónov v orbitáli-každý orbitál má 2 elektróny, pričom sa tieto elektróny líšia svojim spinom. Orbitál "s" nie je degenerovaný, preto obsahuje 2 elektróny (s2), orbital "p" je 3x degenerovaný, a preto obsahuje 3x2 = 6 elektronov (p6), orbitál "d" je 5x degenerovaný a obsahuje 5x2 = 10 elektrónov (d10) a nakoniec orbitál "f" je 7x degenerovaný a obsahuje 7x2 = 14 elektrónov (f14). Napr. jediný obsadený orbitál atómu hélia v základnom stave sa označuje 1s² – obsahuje 2 elektróny na najnižšej energetickej úrovni (n=1) a ich moment hybnosti je l=0. Hypoteticky existujú i ďalšie typy orbitálov než sú s, p, d, f.
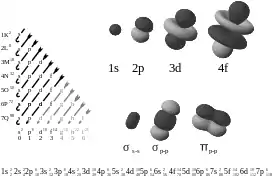
Tabuľka orbitálov
Táto tabuľka ukazuje všetky orbitálové konfigurácie pre vodík a vodíku podobné atómy až po 7s.
| s (l=0) | p (l=1) | d (l=2) | f (l=3) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| m=0 | m=0 | m=±1 | m=0 | m=±1 | m=±2 | m=0 | m=±1 | m=±2 | m=±3 | |||||||
| s | pz | px | py | dz2 | dxz | dyz | dxy | dx2-y2 | fz3 | fxz2 | fyz2 | fxyz | fz(x2-y2) | fx(x2-3y2) | fy(3x2-y2) | |
| n=1 |  |
|||||||||||||||
| n=2 |  |
 |
 |
 |
||||||||||||
| n=3 |  |
 |
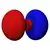 |
 |
 |
 |
 |
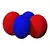 |
 |
|||||||
| n=4 |  |
 |
 |
 |
 |
 |
 |
 |
 |
|||||||
| n=5 |  |
 |
 |
 |
 |
 |
 |
 |
 |
. . . | . . . | . . . | . . . | . . . | . . . | . . . |
| n=6 |  |
 |
 |
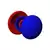 |
. . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . |
| n=7 |  |
. . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . |