Chlorid berýlnatý
Chlorid berýlnatý (BeCl2) je anorganická zlúčenina. Ide o bezfarebnú až bielu alebo žltú kryštalickú a hygroskopickú látku dobre rozpustnú v mnohých polárnych rozpúšťadlách.
| Chlorid berýlnatý | |||||||||||||||||||||||||||||||||
 Chlorid berýlnatý | |||||||||||||||||||||||||||||||||
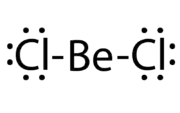 Chlorid berýlnatý | |||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||
| Sumárny vzorec | BeCl2 | ||||||||||||||||||||||||||||||||
| Vzhľad | Bezfarebná, biela alebo žltá kryštalická látka | ||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 80,0 u | ||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 79,918 2 g/mol | ||||||||||||||||||||||||||||||||
| Teplota topenia | 399 °C, 672 K, 750 °F | ||||||||||||||||||||||||||||||||
| Teplota varu | 482 °C, 755 K, 900 °F | ||||||||||||||||||||||||||||||||
| Hustota | 1,899 g/cm³ 1,835 g/cm³ (dihydrát) 1,712 g/cm³ (pevná látka) | ||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 15,1 g/100 ml (20 °C) v polárnych rozpúšťadlách: alkoholy éter v nepolárnych rozpúšťadlách: pyridín | ||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −490,4 kJ/mol | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||
| Číslo CAS | 7787-47-5 | ||||||||||||||||||||||||||||||||
| EINECS číslo | 232-116-4 | ||||||||||||||||||||||||||||||||
| Číslo RTECS | DS2625000 | ||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||
Jeho vlastnosti sú takmer rovnaké ako u chloridu hlinitého.
Príprava
Chlorid berýlnatý sa pripravuje zlučovaním kovového berýlia s chlórom pri vysokej teplote.[1]
- Be + Cl2 → BeCl2
Tiež je možné ho pripraviť redukciou oxidu berýlnatého uhlíkom pri vysokej teplote za prítomnosti chlóru.[2]
Štruktúra
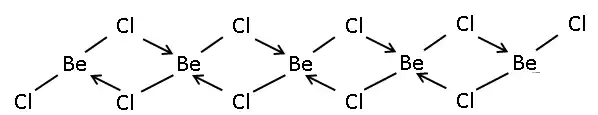
Pevný chlorid berýlnatý je jednorozmerný polymér pozostávajúci z tetraédrických štruktúr.[3]
Líši sa tým od fluoridu berýlnatého, ktorý je trojrozmerným polymérom so štruktúrou podobnou štruktúre kremeňa.
Podobné látky
- Fluorid berýlnatý
- Bromid berýlnatý
- Jodid berýlnatý
- Chlorid horečnatý
- Chlorid vápenatý
- Chlorid strontnatý
- Chlorid bárnatý
- Chlorid radnatý
Referencie
- Irving R. Tannenbaum: "Beryllium Chloride" Inorganic Syntheses, 1957, vol. 5, p.22. DOI: 10.1002/9780470132364.ch7
- Cotton, F.A.; Wilkinson, G. (1980) Advanced Inorganic Chemistry John Wiley and Sons, Inc: New York, ISBN 0-471-02775-8
- Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chlorid beryllnatý na českej Wikipédii.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.




