Fenol
Fenol, benzenol alebo hydroxybenzén (zastarano aj kyselina karbolová) je hydroxyderivát benzénu. Racionálny vzorec fenolu je C6H5OH.
- Pozri aj fenoly.
02.jpg.webp)
Je to tuhá bezfarebná kryštalická látka s charakteristickým zápachom. Na svetle a vzduchu postupne ružovie až hnedne a pôsobením kyslíka zvetráva. Fenol je najjednoduchším zástupcom skupiny aromatických hydroxyderivátov – fenolov.
Vlastnosti
Fyzikálne
Za normálnych podmienok tvorí fenol bezfarebné kryštály, ktoré majú niekedy tendenciu sa roztekať. Teplota topenia je 40,5 °C, teplota varu 181,7 °C a hustota 1070 kg/m3. Rozpustnosť fenolu vo vode je pomerne nízka, ale je možné ju zvýšiť prídavkom silnej zásady (napr. NaOH). Fenol je silné dezinficiens, ale pre svoj zápach a jedovatosť (LDLO = 140 mg/kg) sa už na tieto účely nepoužíva.
Chemické vlastnosti
Fenol je z hľadiska Brønstedovej teórie slabá kyselina (pKa = 9,95), pretože vodík hydroxylovej skupiny je odštiepiteľný v podobe protónu. Zvýšenú kyslosť fenolu oproti jeho alifatickému analógu cyklohexanolu zapríčiňuje vysoká elektrónová hustota na aromatickom jadre.
Fenol poskytuje okrem elektrofilných substitučných reakcií na aromatickom jadre aj reakcie prebiehajúce na hydroxylovej skupine (napr. esterifikácia, tvorba alkalických fenolátov):
- C6H5OH + NaOH → C6H5ONa + H2O
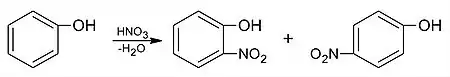
Elektrofilné substitúcie prebiehajú na fenole ľahšie než na benzéne, pretože substituent –OH zvyšuje elektrónovú hustotu jadra, keďže nad záporným indukčným efektom prevláda kladný mezomérny efekt (+M efekt):
Výroba
Fenol sa bežne nachádza v čienouhoľnom dechte a vo vypieracích vodách po karbonizácii čierneho uhlia. Tieto zdroje však zabezpečujú len malú časť svetovej produkcie fenolu (2,2 mil. ton ročne). Technologicky sú dobre zvládnuté viaceré metódy prípravy:
- alkalické tavenie kyseliny benzénsulfónovej
- hydrolýza chlórbenzénu
- kuménový proces.
Najpoužívanejšia metóda je kuménový proces (kumén = izopropylbenzén), pretože pri tomto spôsobe vzniká ako vedľajší produkt acetón.
Použitie
Fenol má veľmi široké spektrum využitia. Najväčšia časť svetovej produkcie sa využíva na výrobu fenolformaldehydových živíc a ε-kaprolaktámu. Fenol je východiskovou surovinou pri príprave mnohých alkylovaných fenolov (krezoly, tymol), liečív, farbív, výbušnín, rozpúšťadiel, zmäkčovadiel a iných látok.
| Chemický portál |