Chlorid nikelnatý
Chlorid nikelnatý (NiCl2) je v bezvodom stave zlatožltá hygroskopická práškovitá látka. V závislosti na hydratácii sa mení jeho farba. Je dobre rozpustný vo vode a tiež metanole, etanole, glycerole a dietyléteri. Dihydrát tvorí hnedožlté, tetrahydrát žltozelené a hexahydrát sýto zelené kryštály. V prírode sa zriedkavo vyskytuje v podobe hexahydrátu ako minerál nikelbischofit. Chlorid nikelnatý je východzou zlúčeninou pre ďalšie nikelnaté zlúčeniny i chemické syntézy. Rovnako ako ďalšie zlúčeniny niklu je karcinogénny.
| Chlorid nikelnatý | |||||||||||||||||||||||||||||||||||||||
 Chlorid nikelnatý | |||||||||||||||||||||||||||||||||||||||
 Chlorid nikelnatý | |||||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Sumárny vzorec | NiCl2 | ||||||||||||||||||||||||||||||||||||||
| Vzhľad | zlatožltý prášok (bezvodný) hnedožlté kryštály (dihydrát) žltozelené kryštály (tetrahydrát) zelené kryštály (hexahydrát) | ||||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 129,6 u (bezvodný) 165,6 u (dihydrát) 201,7 u (tetrahydrát) 237,7 u (hexahydrát) | ||||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 129,60 g/mol (bezvodný) 165,63 g/mol (dihydrát) 201,66 g/mol (tetrahydrát) 237,69 g/mol (hexahydrát) | ||||||||||||||||||||||||||||||||||||||
| Teplota topenia | 1 009 °C (196 kPa) (bezvodný) 80 °C (hexahydrát) | ||||||||||||||||||||||||||||||||||||||
| Teplota sublimácie | 970 °C | ||||||||||||||||||||||||||||||||||||||
| Hustota | 3,508 g/cm³ (bezvodný) 2,56 g/cm³ (dihydrát) 2,217 g/cm³ (20 °C, tetrahydrát) 1,92 g/cm³ ( 20 °C, hexahydrát) | ||||||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: bezvodný 53,4 g/100 ml (0 °C) 65,6 g/100 ml (25 °C) 76,0 g/100 ml (50 °C) 86,2 g/100 ml (75 °C) 87,6 g/100 ml (100 °C) dihydrát 143,52 g/100 ml (70 °C) 144,32 g/100 ml (80 °C) 146,87 g/100 ml (100 °C) tetrahydrát 184,88 g/100 ml (30 °C) 190,13 g/100 ml (40 °C) 233,47 g/100 ml (60 °C) hexahydrát 174,5 g/100 ml (0 °C) 475,5 g/100 ml (60 °C) 596 g/100 ml (100 °C) v polárnych rozpúšťadlách: metanol etanol glycerol dietyléter | ||||||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Entropia rozpúšťania | -642 J/g | ||||||||||||||||||||||||||||||||||||||
| Entropia sublimácie | 1 737 J/g | ||||||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | -316,1 kJ/mol (bezvodný) -924,4 kJ/mol (dihydrát) -1 527,0 kJ/mol (tetrahydrát) -2 116,2 kJ/mol (hexahydrát) | ||||||||||||||||||||||||||||||||||||||
| Štandardná entropia | 98,07 J K-1 mol-1 | ||||||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | -272,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,533 J K-1 g-1 | ||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||||
| Číslo CAS | 7718-54-9 (bezvodný) 7791-20-0 (hexahydrát) | ||||||||||||||||||||||||||||||||||||||
| Číslo UN | 3288 | ||||||||||||||||||||||||||||||||||||||
| EINECS číslo | 231-743-0 | ||||||||||||||||||||||||||||||||||||||
| Číslo RTECS | QR6480000 | ||||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||||
Výroba
Chlorid nikelnatý sa získava premývaním zvyškov po výrobe niklu kyselinou chlorovodíkovou a priemyselne potom priamou syntézou chlóru a niklu.
- Ni + Cl2 → NiCl2
Pre získanie bezvodej soli z hexahydrátu nemožno využiť tepelnú dehydratáciu. Najvýhodnejšie je vysušiť ho pomocou tionylchloridu (SOCl2) za tepla alebo za zahrievania v prúde plynného chlorovodíka HCl:
- NiCl2•6 H2O + 6 SOCl2 → NiCl2 + 6 SO2 + 12 HCl
Dehydratácia je sprevádzaná zmenou farby zo zelenej na žltú.
Využitie
Chlorid nikelnatý a jeho hydráty sa využívajú v organickej syntéze.
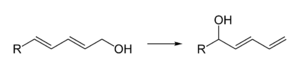
Ako slabá Lewisova kyselina napr. pre regioselektivnú izomerizáciu diénov:
- V kombinácii s chloridom chrómnatým CrCl2 pre reakciu aldehydov s vinyljodidmi za vzniku alylových alkoholov.
- Selektívne zníženie prítomnosti tetrahydridohlinitanu lítneho (Li[AlH4]), napríklad pre konverziu alkénov na alkány.
- Ako prekurzor „boridu niklu“, pripravený priamo v reakčnej zmesi z chloridu nikelnatého a tetrahydridoboridu sodného (Na[BH4]). Toto činidlo sa chová ako Raneyov nikel a rovnako ako on má tiež vysokú katalyzačnú schopnosť pre hydrogenáciu nenasýtených karbonylových zlúčenín.
- V jemnej práškovej podobe niklu získaného redukciou zinku ako prekurzor k redukcii aldehydov, alkénov a nitro aromatických zlúčenín. Toto činidlo tiež umožňuje reakcie dvoch alkylhalogenidov - 2RX → RR, kde R = aryl, vinyl.
- Ako katalyzátor pre výrobu dialkylarylfosfidov z fosfidov a aryljodidov:
- ArI + P(OEt)3 → ArP(O)(OEt)2 + EtI
Podobné látky
- Bromid nikelnatý
- Fluorid nikelnatý
- Jodid nikelnatý
- Chlorid paladnatý
- Chlorid platiničitý
- Chlorid platnato-platiničitý
- Chlorid platnatý
- Chlorid kobaltnatý
- Chlorid meďnatý
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chlorid nikelnatý na českej Wikipédii.