Chlorid meďný
Chlorid meďný (CuCl) je anorganická zlúčenina, jeden z chloridov medi. Ide o bielu tuhú látku zle rozpustnú vo vode, ale dobre rozpustnú v koncentrovanej kyseline chlorovodíkovej. Nečisté vzorky sú zelenkasté vďaka prítomnosti zeleného chloridu meďnatého.[1]
| Chlorid meďný | |||||||||||||||||||||||||||||||||||||
-chloride-sample.jpg.webp) Chlorid meďný | |||||||||||||||||||||||||||||||||||||
 Chlorid meďný | |||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||
| Sumárny vzorec | CuCl | ||||||||||||||||||||||||||||||||||||
| Vzhľad | biely prášok | ||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 99,0 u | ||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 98,999 g/mol | ||||||||||||||||||||||||||||||||||||
| Teplota topenia | 430 °C | ||||||||||||||||||||||||||||||||||||
| Teplota varu | 1 212 °C | ||||||||||||||||||||||||||||||||||||
| Hustota | 4,139 g/cm³ | ||||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 1,25 g/100 ml v polárnych rozpúšťadlách: kyselina chlorovodíková roztoky amónnych solí roztoky kyanidov | ||||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||||
| Entropia topenia | 103,5 J/g | ||||||||||||||||||||||||||||||||||||
| Entropia varu | 219,2 J/g | ||||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −136,5 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Štandardná entropia | 87,1 J K−1 mol−1 | ||||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | −114,06 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,489 9 J K−1 g−1 | ||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||
| Číslo CAS | 7758-89-6 | ||||||||||||||||||||||||||||||||||||
| Číslo UN | 2802 | ||||||||||||||||||||||||||||||||||||
| EINECS číslo | 231-842-9 | ||||||||||||||||||||||||||||||||||||
| Číslo RTECS | GL6990000 | ||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||
Vlastnosti
chloride_crystal_01.jpg.webp)
Chlorid meďný je Lewisova kyselina, klasifikovaná podľa konceptu HSAB ako „mäkká“. Preto má tendenciu tvoriť stabilné komplexy s mäkkými Lewisovými hydroxidmi, napríklad trifenylfosfínom:
- CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
Hoci sa chlorid meďný príliš nerozpúšťa vo vode, rozpúšťa sa vo vodných roztokoch obsahujúcich vhodné donorové molekuly. Tvorí komplexy s halogenidovými iónmi; napríklad s koncentrovanou kyselinou chlorovodíkovou tvorí H3O+CuCl2-. Podobne tvorí komplexy aj s aniónom kyanidu, aniónom tiosíranu a amoniakom.
Roztoky chloridu meďného s chlorovodíkom alebo amoniakom pohlcujú oxid uhoľnatý za vzniku bezfarebných komplexov, napríklad diméru s chloridovým mostíkom [CuCl(CO)]2. Rovnaký roztok s chlorovodíkom reaguje tiež s acetylénom na [CuCl(C2H2)]. Roztok s amoniakom dáva s acetylénom výbušný acetylid meďný. Komplexy chloridu meďného s alkénmi možno pripraviť redukciou chloridu meďnatého oxidom siričitým za prítomnosti alkénu v alkoholovom roztoku. Komplexy s diénmi, napr. 1,5-cyklooktadiénom, sú obzvlášť stabilné:[2]
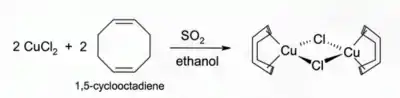
Za neprítomnosti iných ligandov sú vodné roztoky chlorid meďného nestabilné vzhľadom k disproporcionácii na meď a chlorid meďnatý.[3] Čiastočne z tohto dôvodu sa chlorid meďný na vzduchu sfarbuje dozelena.
Použitie
Hlavné použitie chloridu meďného je ako prekurzor pre výrobu fungicídneho oxychloridu meďnatého. Na tento účel sa chlorid meďný generuje synproporcionáciu a potom sa oxiduje vzduchom:
- Cu + CuCl2 → 2 CuCl
- 6 CuCl + 3/2 O2 + 3 H2O → 2 Cu3Cl2(OH)4 + CuCl2
Chlorid meďný katalyzuje veľa organických reakcií. Jeho afinita k oxidu uhoľnatému v prítomnosti chloridu hlinitého sa využíva v procese COPureSM.
Organická syntéza
V Sandmeyerovej reakcii vedie pôsobenie chloridu meďného na aréndiazóniové soli k vzniku arylchloridov, napríklad:[4]

Táto reakcia má široký záber a obvykle ponúka vysokú výťažnosť.
Polyméry
Chlorid meďný sa používa ako katalyzátor v radikálovej polymerizácii prenosom atómu (ATRP).
Podobné zlúčeniny
- Bromid meďný
- Jodid meďný
- Chlorid meďnatý
- Chlorid strieborný
Referencie
- United States Patent US4582579 "method of preparing cupric ion free cuprous chloride" Section 2, lines 4-41, via www.freepatentsonline.com
- Nicholls, D. Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- (a) Wade, L. G. Organic Chemistry, 5th ed., p. 871, Prentice Hall, Upper Saddle RIver, New Jersey, 2003. (b) March, J. Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
- Mellor, J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemistry, Volume III, pp157-168. Longmans, Green & Co., London, 1967 (new impression)
Externé odkazy
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chlorid měďný na českej Wikipédii.




