Chlorid hlinitý
Chlorid hlinitý (AlCl3) je zlúčenina hliníka a chlóru. Ide o pevnú látku s nízkym bodom topenia a varu, atómy v molekule sú viazané kovalentne. Pri teplote 178 °C sublimuje. Roztavený chlorid hlinitý je zlým vodičom elektriny,[1] na rozdiel od iónovo viazaných halogenidov, ako je napríklad chlorid sodný. V pevnej fáze sa vyskytuje v podobe hexagonálných kryštálov.
| Chlorid hlinitý | |||||||||||||||||||||||||||||||
 Chlorid hlinitý | |||||||||||||||||||||||||||||||
 Chlorid hlinitý | |||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||
| Sumárny vzorec | AlCl3 AlCl3 • 6 H2O (hexahydrát) | ||||||||||||||||||||||||||||||
| Vzhľad | Bezvodý, biely prášok; hydrátovaný, žltkasté až žlté kryštáliky | ||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 133,3 u (bezvodný) 241,4 u (hexahydrát) | ||||||||||||||||||||||||||||||
| Molárna hmotnosť | 133,34 g/mol (bezvodný) 241,432 g/mol (hexahydrát) | ||||||||||||||||||||||||||||||
| Teplota topenia | 192,6 °C (229 kPa, bezvodý) 100 °C (hexahydrát) | ||||||||||||||||||||||||||||||
| Teplota varu | 120 °C (hexahydrát) | ||||||||||||||||||||||||||||||
| Teplota sublimácie | 178,4 °C | ||||||||||||||||||||||||||||||
| Teplota rozkladu | 100 °C (hexahydrát) | ||||||||||||||||||||||||||||||
| Hustota | 2,456 g/cm³ (17 °C) 2,44 g/cm³ (20 °C) 1,664 g/cm³ (20 °C, hexahydrát) | ||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: bezvodný 44,9 g/100 ml (0 °C) 46,3 g/100 ml (25 °C) 47 g/100 ml (30 °C) 46,5 g/100 ml (60 °C) Hexahydrát 123,4 g/100 ml (0 °C) 131,9 g/100 ml (20 °C) 147,2 g/100 ml (100 °C) v polárnych rozpúšťadlách Etanol 100 g/100 ml (12,5 °C) v nepolárnych rozpúšťadlách: Trichlórmetán 0,72 g/100 ml (25 °C) | ||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −704,2 kJ/mol | ||||||||||||||||||||||||||||||
| Štandardná entropia | 109,3 J K−1 mol−1 | ||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | −628,6 kJ/mol | ||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,683 J K−1 g−1 (bezvodný) 1,315 J K−1 g−1 (hexahydrát) | ||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||
| Číslo CAS | 7446-70-0 (bezvodný) 10124-27-3 (hexahydrát) | ||||||||||||||||||||||||||||||
| Číslo UN | 3264 | ||||||||||||||||||||||||||||||
| EINECS číslo | 231-208-1 | ||||||||||||||||||||||||||||||
| Číslo RTECS | BD0530000 | ||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||
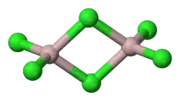
Chlorid hlinitý má štruktúru „chlorida iridného“ s kubickou, tesne zaplnenou vrstvenou kryštalickou štruktúrou Al3+.[2] Na rozdiel od bromidu hlinitého má štruktúru viac molekulárnu, kde centrá Al3+ obsadzujú priľahlé štvorstenné diery v tesne zaplnenej mriežke iónov Br-. Pri topení chloridu hlinitého vzniká dimér, ktorý sa môže vyparovať. Pri vyšších teplotách tento dimér disociuje do trojuholníkových planárnych molekúl chlorida hlinitého, štrukturálne analogických fluoridu boritému.
Chlorid hlinitý je silne hygroskopický a pri náhlom kontakte s vodou môže explodovať, vzhľadom k značnému vývinu tepla pri hydratácii. Vodné roztoky chloridu hlinitého sú iónové a vedú teda dobre elektrický prúd. Tieto roztoky sú kyslé, čo indikuje čiastočnú hydrolýzu iónu Al3+. Reakciu možno zjednodušene opísať takto:
- [Al(H2O)6]3+ + H2O ⇌ [Al(OH)(H2O)5]2+ + H3O+
Chlorid hlinitý je pravdepodobne najčastejšie používanou Lewisovu kyselinou a tiež jednou z najsilnejších. Nachádza široké uplatnenie v chemickom priemysle ako klasický katalyzátor pre Friedel-Craftovu reakciu, ako acylačný, tak alkylačný. Používa sa tiež pri polymerizačných a izomerizačných reakciách uhľovodíkov. Hliník tvorí s chlórom okrem chloridu hlinitého ešte chlorid hlinný, ten je však veľmi nestabilný a je známy len v plynnej fáze.[1]
Opis

Chlorid hlinitý je silnou Lewisovou kyselinou, schopnou tvoriť stabilnú Lewisovu acidobázicko-adičnú zlúčeninu aj so slabými Lewisovými hydroxidmi, ako je benzofenón alebo mesitylén.[3] Nie je prekvapivé, že v prítomnosti chloridových iónov tvorí ióny AlCl4-. Vo vode vzniká čiastočnou hydrolýzou chlorovodík alebo katión H3O+, ako je popísané vyššie. Vodné roztoky sa správajú podobne ako u iných solí hliníka obsahujúcich hydratované ióny Al3+, kedy vzniká pologél (zrazenina hydroxidu hlinitého) reakciou s príslušným množstvom hydroxidu sodného:
- AlCl3(aq) + 3 NaOH (aq) → Al (OH)3(s) + 3 NaCl (aq)
Príprava
Chlorid hlinitý sa vo veľkej miere vyrába exotermickou reakciou kovového hliníka s chlórom alebo chlorovodíkom pri teplotách 650 až 750 °C:[1]
- 2 Al + 3 Cl2 → 2 AlCl3
- 2 Al + 6 HCl → 2 AlCl3 + 3 H2
Hydratované formy sa pripravujú rozpúšťaním oxidov hliníka v suchej kyseline chlorovodíkovej pri 150 °C.
Pri výrobe v laboratóriu musí byť reakcia vykonávaná veľmi opatrne, pretože hliník je pri tejto reakcii zradný: vďaka vrstvičke oxidu hlinitého sprvu vyzerá, že reaguje veľmi pomaly, ale do cca 15 sekúnd začne rýchlosť stúpať, a po 1 minúte je už skoro v maxime. Ak chemik mysliac si, že rýchlosť reakcie je rovnaká ako krátko po vhodení hliníka do kyseliny, neustále prihadzuje kúsky hliníka, môže dôjsť k značným komplikáciám, pretože sa roztok zahrieva, zvyšuje sa teplota a tým pádom aj rýchlosť reakcie, čo môže skončiť zahriatím roztoku na teplotu varu a uvoľňovaním nebezpečného chlorovodíka.
Použitie
Chlorid hlinitý, častejšie však hexahydrát chloridu hlinitého, je hlavnou súčasťou (do 20%) prípravkov proti poteniu na trhu. Vo vedeckých kruhoch sa vedie široká diskusia o škodlivosti hlinitých solí na ľudský organizmus, doteraz sa však nepodarilo priamu škodlivosť preukázať.
Bezpečnosť
Bezvodý chlorid hlinitý búrlivo reaguje s vodou a hydroxidmi, preto je potrebná náležitá opatrnosť. Hydratované soli sú menej problematické.
Podobné látky
- Bromid hlinitý
- Fluorid hlinitý
- Jodid hlinitý
- Chlorid boritý
- Chlorid galitý
- Chlorid inditý
- Chlorid horečnatý
- Chlorid železitý
- Fluorid boritý
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chlorid hlinitý na českej Wikipédii.
Referencie
- N. N. Greenwood, A. Earnshaw: Chemistry of the Elements, Pergamon Press, Oxford, United Kingdom, 1984
- A. F. Wells: Structural Inorganic Chemistry, Oxford Press, Oxford, United Kingdom, 1984
- GA Olah (ed.), Friedel-Crafts and Related Reactions, Vol. 1, Interscience, New York, 1963.
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.


