Atóm
Atóm (grec. άτομον – nedeliteľný) je najmenšia, chemicky ďalej nedeliteľná častica chemického prvku, ktorá je nositeľom jeho vlastností. Skladá sa z jadra a obalu. V jadre atómu sú protóny a neutróny, v obale sú elektróny (usporiadané vo vrstvách).


Tento pojem atómu zaviedli grécki filozofi Leukippos z Milétu a Démokritos z Abdér, všeobecne sa ujal až na začiatku 19. storočia. Ernest Rutherford a Niels Bohr objavili subatomárne častice a tým sa dokázalo, že atóm nie je nedeliteľný. Atómy sa ďalej zlučujú do molekúl. V prirodzenom prostredí majú rovnaký počet elektrónov aj protónov, v tomto stave je atóm elektroneutrálny. Ak sa tento pomer zmení, vzniká ión, ktorý je buď kladný (katión) alebo záporný (anión). Molekula, atóm či dokonca jeho subatomárne častice sú v neustálom pohybe.
Atóm podľa Demokrita
Atóm je jednotlivá častica uzavretá v sebe, nedeliteľná a plná, oddelená akýmsi prázdnom, čiže nebytím od každej inej jednotlivej častice. Z týchto jednotlivých častí sa skladá celá pozorovateľná skutočnosť, ale ony samy sú postihnuteľné len prostredníctvom rozumového poznania. Atóm je bytím nevznikajúcim ani nehynúcim, je čímsi obsahom rovnorodým. Atómy sa líšia iba podobou a veľkosťou. Nepodlieha kvalitatívnym zmenám, ale len kvantitatívnym zmenám. Atóm má tri základné vlastnosti: tvar, polohu a miesto.
Atóm podľa Diderota
Atóm je entita, z ktorej pozostáva svet i veci v ňom. Každý atóm prejavuje sily príťažlivosti, pohyb a schopnosť pociťovať: je to akási zmaterializovaná Leibnizova monáda. Každý atóm sa kvalitatívne líši od každého iného atómu. Každý atóm má päť odlíšiteľných vlastností: pohyb, dĺžku, výšku, nepriestupnosť a citlivosť.
Vzájomnou výmenou prvkov a ich vlastností vzniká rôznorodosť vecí a javov vo svete, a to prechodom zo stavu driemajúcej citlivosti v atómoch až do stavu jej maximálneho rozvoja v podobe ľudského rozumu
Atómová teória
Taktiež nazývaná Daltonova teória podľa objaviteľa Johna Daltona.
Začiatkom 19. storočia sa Dalton zaoberal rozborom chemických látok a pozorovaním chemických reakcií. Svoje závery spísal do troch zákonov:
- Všetky látky sa skladajú z veľmi malých, nedeliteľných častíc – atómov. Atómy toho istého prvku sú rovnaké, atómy rôznych prvkov sú rôzne a líšia sa svojimi vlastnosťami.
- Počas chemickej reakcie nastáva vzájomné spájanie, oddeľovanie a preskupovanie atómov. Počas chemickej reakcie atómy nevznikajú, nezanikajú a nemenia sa na atómy iného prvku.
- Ak dva prvky tvoria navzájom niekoľko zlúčenín, hmotnosti jedného prvku pripadajúce v nich na jednu a tú istú hmotnosť druhého prvku sú v pomere malých celých čísel.
Subatomárne častice
Subatomárna častica |
Objaviteľ (rok) | Hmotnosť (kg) | Náboj (veľkosť náboja) (C) | Symbol |
|---|---|---|---|---|
| protón | Ernest Rutherford (1918) | 1,6729×10−27 | kladný (1,60210 × 10−19) | p+, H+ |
| neutrón | James Chadwick (1932) | 1,6749×10−27 | bez náboju | n |
| elektrón | Joseph John Thomson (1897) | 9,1091 x 10−31 | záporný (1,60210 × 10−19) | e- |
Samotné protóny a neutróny nie sú elementárnymi časťami – skladajú sa z „elementárnejších“ častíc – kvarkov.
Stavba atómu
Atómové jadro
Atómové jadro pozostáva z dvoch druhov častíc, z protónov a neutrónov. Počet protónov v jadre sa označuje ako protónové číslo (Z). Určuje príslušnosť atómu k určitému chemickému prvku. Podľa protónového čísla sú prvky zoradené do periodickej tabuľky. V prírode sa vyskytujú atómy s protónovým číslom od Z = 1 (vodík) po Z = 92 (urán), umelo sa podarilo vytvoriť transuránové atómové jadrá s protónovým číslom Z = 118 (oganesón).
Počet neutrónov v jadrách toho istého prvku môže byť odlišný. Súhrnný počet protónov a neutrónov vyjadruje nukleónové číslo (A). Rozdiel A−Z zodpovedá počtu neutrónov. Vyjadruje ho neutrónové číslo N. Látka, ktorej atómy sú definované určitým protónovým a nukleónovým číslom, je nuklid. Pri rôznych počtoch neutrónov vznikajú izotopy, pozri nižšie.
Protóny a neutróny sú v jadre atómu viazané jadrovými silami, ktoré patria k silným interakciám častíc. Jadrové sily sú veľmi účinné, majú však dosah iba na malé vzdialenosti: Polomer ich účinnosti nepresahuje 4×10−15 m. Polomer atómového jadra (R) je približne 1,2×10−15 m. Polomer jadra uránu je napríklad 7,4×10−15 m. Hustota atómových jadier je približne 1017 kg.m-3 nezávisle od veľkosti jadra.
Hmotnosť jadra určuje celkovú hmotnosť atómu, pretože hmotnosť elektrónu je zanedbateľná. Hmotnosť atómového jadra je vždy o niečo menšia ako súčet hmotností protónov a neutrónov, ktoré tvoria jadro (defekt hmotnosti). Tento rozdiel je zdrojom väzbovej energie jadra, ktorá určuje stabilitu jadra. Jadrá s počtom neutrónov alebo protónov 2, 8, 14, 20, 28, 50, 82 a 126 (magické čísla) majú najväčšiu väzbovú energiu, preto sú najstabilnejšie a najčastejšie sa vyskytujú v prírode (kozmický výskyt prvkov).
Elektrónový obal
Hlavný článok o elektrónoch pozri elektrón.
Elektrónový obal atómu tvoria elektricky záporne nabité elektróny. Počet elektrónov v normálnom atóme sa rovná počtu protónov v jeho jadre, t. j. protónovému číslu Z. V tomto prípade je atóm ako celok elektricky neutrálny. Každý elektrón v obale atómu sa nachádza v určitom energetickom stave, ktorý je určený štyrmi kvantovými číslami.
Elektrónový obal určuje jeho chemické i optické vlastnosti. Ak atóm interaguje so žiarením, môže elektrón v jeho obale žiarenie absorbovať a dostať sa tak na vyššiu energetickú hladinu (excitácia). Z vyššej hladiny prejde elektrón takmer ihneď do nižšej hladiny, pričom vyšle kvantum žiarenia určitej vlnovej dĺžky (emisia žiarenia). Frekvenciu absorbovaného i emitovaného žiarenia v pritom určuje rozdiel energií hladín ΔE podľa vzťahu v = ΔE/h, kde h je Planckova konštanta. Ak v určitom prostredí je veľký počet atómov takým spôsobom absorbuje alebo emituje žiarenie s rovnakou frekvenciou, prejaví sa v jeho spektre absorpčná alebo emisná spektrálna čiara. Z pozorovanej frekvencie spektrálnych čiar možno spätne určiť, medzi ktorými energetickými hladinami a v akých atómoch nastal prechod elektrónov. Ak absorbovaná energia prevýši určitú hraničnú hodnotu, elektrón sa celkom odtrhne od atómu. Ak atóm stratí jeden alebo viac elektrónov, stáva sa ionizovaným. (ión, ionizácia). Ak naopak ionizovaný atóm zachytí do svojho obalu voľný elektrón, nastáva rekombinácia atómu. Jednoduchú predstavu štruktúry atómu vyjadruje Bohrov model atómu.
Pauliho princíp
Podľa Pauliho princípu sa nemôžu v atóme nachádzať dva elektróny v rovnakom energetickom stave, t. j. s rovnakými všetkými kvantovými číslami; aspoň jedným kvantovým číslom sa musia odlišovať. Pauliho princíp súčasne určuje štruktúru elektrónového obalu atómu, pozostávajúcu z viacerých sfér (zodpovedajúcich rôznym hodnotám hlavného kvantového čísla), podsféry (zodpovedajúcich vedľajším kvantovým číslam) a stavov (zodpovedajúcich magnetickým kvantovým číslam), v ktorých sa elektróny môžu nachádzať.
Izotop
- Hlavný článok o izotopoch pozri izotop.
Atómy s rovnakým počtom protónov, ale s rôznym počtom neutrónov sú izotopmi určitého chemického prvku.
Napríklad vodík má voľne v prírode tri rôzne izotopy:
- jadro obyčajného vodíka (prócia) tvorí len jeden protón bez neutrónu *
- jadro ťažkého vodíka (deutéria) pozostáva z jedného protónu a jedného neutrónu*
- jadro trícia má jeden protón a dva neutróny*
Atóm cínu s 50 protónmi v jadre môže mať až 26 rozličných izotopov, z ktorých 10 sa vyskytuje bežne v prírode. Známych je asi 300 stabilných a vyše 1000 nestabilných izotopov.
*Počet elektrónov v atóme je pri izotopoch irelevantný.
Označenie
Na označenie rôznych atómov sa používa chemická značka, pred ktorými sa napíše nukleónové číslo AX a protónové číslo ZX; napríklad 4He je atóm izotopu hélia s dvoma protónmi a dvoma neutrónmi. Protónové číslo, ktoré vyjadruje sama značka chemického prvku, sa často vynecháva.
Stabilita
Vysvetlenie rôznej stability jadier a magických čísiel spočíva v štruktúre atómového jadra. Podľa vrstvového modelu môžu sa nukleóny vyskytovať v jadre iba na určitých energetických hladinách vo vrstvách určených kvantovými číslami. Jadro má najväčšiu stabilitu vtedy, keď sú tieto vrstvy zaplnené; magické čísla zodpovedajú počtu neutrónov alebo protónov, ktoré práve vypĺňajú jednotlivé vrstvy. Väzbová energia na jeden nukleón rastie so vzrastajúcim nukleónovým číslom, najväčšia je pri nukleónovom čísle A = 50 a pri ťažších jadrách opäť klesá vplyvom prevahy elektrických odpudivých síl medzi protónmi jadra nad úzkoúčinnými jadrovými príťažlivými silami.
Dôsledkom tejto závislosti sú dva možné druhy jadrových procesov – syntéza ľahkých jadier na ťažšie a rozpad ťažkých jadier na na ľahšie. Hmotnosť ťažšieho jadra, ktoré vzniklo z ľahších jadier, je menšia ako súčet ich hmotností; preto sa pri takejto jadrovej reakcii uvoľní jadrová energia zodpovedajúca rozdielu hmotností. Obdobne, hoci v relatívne menšom množstve, sa uvoľní jadrová energia i pri rozpade ťažších jadier (rádioaktivita). Syntéza ľahkých jadier na ťažšie sa môže uskutočňovať iba pri veľmi vysokých teplotách a je hlavným zdrojom žiarivej energie hviezd (termonukleárna fúzia). Syntézou jadier v začiatočných horúcich fázach vývoja vesmíru a procesmi vo hviezdach sa vytvorili všetky chemické prvky.
Model atómu
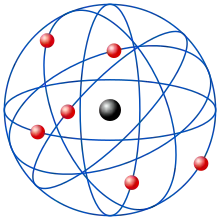
Planetárny model atómu
- Hlavný článok pozri Planetárny model atómu.
Jeden z prvých modelov atómu bol založený na zákonoch klasickej fyziky. Podľa neho pohyb elektrónu okolo jadra by musel byť sprevádzaný elektromagnetickým žiarením a tým by energia elektrónu klesala, polomer medzi jadrom a elektrónom by sa stále zmenšoval a napokon e- by dopadol do jadra a tam zanikol, to by spôsobilo aj zánik atómu.
Rutherfordov model atómu
Ernest Rutherford v roku 1911 pozoroval prechod usmerneného alfa žiarenia veľmi tenkou zlatou fóliou (bombardoval zlatú fóliu alfa žiarením z hélia).
Väčšina častíc prechádzala cez fóliu priamo. Niektoré alfa častice sa odchýlilo z pôvodného smeru o malý uhol a veľmi malé množstvo (asi jedna z dvadsať tisíc) sa odrazilo o uhol väčší než 90 stupňov. Takú veľkú odchýlku môže spôsobiť len veľmi silný kladný náboj, ktorý odpudzuje kladne nabité častice. Pretože sa odchýli iba malá časť častíc, Rutherford dokázal, že kladný náboj je sústredený na malý priestor, v ktorom je celá hmota atómu. Túto časť atómu nazval atómovým jadrom. Z nameraných odchýlok vypočítal, že polomer jadra je asi 10−14 m až 10−15 m.
O atóme sa predpokladalo, že má tvar gule s polomerom 10−10 m. Na základe experimentálnych výsledkov vyslovil Rutherford teóriu o štruktúre atómu:
- Atóm je zložený z malého, kladne nabitého jadra a záporne nabitých elektrónov, ktoré obiehajú po kruhových dráhach okolo atómového jadra ako planéty okolo slnka a tvoria elektrónový obal.
- Atóm ako celok je prázdny, ale jadro atómu je malé a pritom nahustené.
- Odstredivá sila kompenzuje elektrostatickú príťažlivú silu
Principiálnym nedostatkom teórie je, že podľa klasickej teórie prechodom elektrického prúdu (jednoelektrónového) dochádza k zmene magnetického toku a teda k vyžarovaniu elektromagnetického žiarenia. Zo zákona zachovania energie vyplýva, že elektrón stratí časť kinetickej energie a teda musí znížiť rýchlosť. Aby tejto rýchlosti prislúchajúca odstredivá sila bola v rovnováhe s elektrostatickou interakciou s jadrom musí elektrón zmenšiť polomer svojej dráhy. Tento proces by pokračoval a to spojito (teda po špirále) až pokiaľ by elektrón nesplynul s jadrom. Teoreticky vypočítaná doba tohto procesu je extrémne krátka a teda model nevysvetľuje stabilitu atómov.
Bohrov model atómu
- Hlavný článok pozri Bohrov model atómu.
Niels Bohr v roku 1913 doplnil Rutherfordov planetárny model atómu s predpokladom, že sa elektróny po stacionárnych dráhach pohybujú bez straty energie. Pohyb bez straty energie je nutný k tomu aby elektrón 'nespadol' zo svojej dráhy. Možnosť či skôr nutnosť pohybovať sa bez straty energie je nutným dôsledkom kvantovania energie. Elektrón totiž nemôže vyžiariť akúkoľvek malú energiu ale iba kvantovanú. Ak (nepresne povedané) vychádza podľa klasickej teórie energia menšia ako najmenšie možné kvantum, tak elektrón nevyžiari jednoducho nič. Z toho vyplýva, že elektrón sa môže pohybovať bez straty energie. Dôvodom stability atómov je teda existencia kvantovania energie. A teda na postulovaní Bohrových podmienok nie je nič magické (ako sa pri niektorých nesprávnych výkladoch môže zdať) ale sú prirodzeným a nutným dôsledkom kvantovania energie.
Elektrón stráca alebo získava energiu po kvantách a to iba pri prechode z jednej energetickej hladiny na inú.
Kvantovo mechanický model atómu
- Hlavný článok pozri Kvantovo mechanický model atómu.
Chovanie častíc, t. j. protónov a elektrónov sa zásadne líši od pohybu iných bežných telies a nedá sa vystihnúť ich pohyb podľa klasickej newtonovskej mechaniky. Pre popis dejov v atómovej mierke sa vypracovala všeobecnejšia – kvantová mechanika.
Antihmota
- Hlavný článok pozri Antihmota.
Každá častica má svoj opak, takpovediac „fyzikálny zrkadlový obraz“.
- elektrónová antičastica sa volá pozitrón (antielektrón),
- protónová antičastica sa volá antiprotón,
- neutrónová antičastica sa volá antineutrón.
Takisto aj kvarky majú svoje antičastice. Pri leptónoch je to trocha odlišné. Ku každému nabitému leptónu (ako je elektrón) jestvuje párové elektricky neutrálne neutríno a všetky nabité aj elektricky neutrálne leptóny majú aj svoje antičastice. Výskum antičastíc prebieha v CERN-e pomocou obrovského urýchľovača častíc. Antičastice sa dajú vyrobiť kolíziou atómov, no ešte nejestvuje efektívny spôsob udržania antičastíc na dlhšiu než veľmi krátku chvíľu, pretože antičastice pri styku s hmotou okamžite anihilujú.