Bromid hlinitý
Bromid hlinitý (AlBr3) je chemická zlúčenina brómu a hliníka, patrí medzi halogenidy. Najbežnejšou formou je dimér, ktorý je za normálnych podmienok hygroskopická, kryštalická pevná látka.
| Bromid hlinitý | |||||||||||||||||||||||||||||||||||
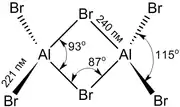 Bromid hlinitý | |||||||||||||||||||||||||||||||||||
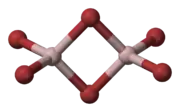 Bromid hlinitý | |||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||
| Sumárny vzorec | AlBr3 (Al2Br6) | ||||||||||||||||||||||||||||||||||
| Vzhľad | biela hygroskopická práškovitá alebo kryštalická pevná látka | ||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 266,7 u | ||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 266,693 g/mol | ||||||||||||||||||||||||||||||||||
| Teplota topenia | 97,1 °C | ||||||||||||||||||||||||||||||||||
| Teplota varu | 255 °C | ||||||||||||||||||||||||||||||||||
| Hustota | 3,205 g/cm³ (18 °C) | ||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: reaguje v polárnych rozpúšťadlách: alkoholy (reaguje) v nepolárnych rozpúšťadlách: tetrachlórmetán (chlorid uhličitý) sírouhlík kvapalné uhľovodíky | ||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||
| Entropia topenia | 42,2 J/g | ||||||||||||||||||||||||||||||||||
| Entropia varu | 188 J/g | ||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | 180,2 J K-1 mol-1 | ||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | -490,6 kJ/mol | ||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,377 J K-1 g-1 | ||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||
| Číslo CAS | 7727-15-3 7784-27-2 (hexahydrát) | ||||||||||||||||||||||||||||||||||
| Číslo UN | 1725 | ||||||||||||||||||||||||||||||||||
| EINECS číslo | 231-779-7 | ||||||||||||||||||||||||||||||||||
| Číslo RTECS | BD0350000 | ||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||
Výroba
Bromid hlinitý sa vyrába niekoľkými spôsobmi, napríklad:
- 6/n "[AlBr]n"→ Al2Br6 + 4 Al alebo
- 2 Al + 6 HBr → Al2Br6 + 3 H2, tiež priamou reakciou hliníka s brómom:
- 2 Al + 3 Br2 → Al2Br6
Reakcia
Bromid hlinitý reaguje s tetrachlórmetánom pri teplote asi 100 °C, pritom vzniká tetrabrómmetán:
- 4 AlBr3 + 3 CCl4 → 4 AlCl3 + 3 CBr4
S fosgénom reaguje za vzniku karbonylbromidu a chlorobromidu hlinitého:
- AlBr3 + COCl2 → COBr2 + AlCl2Br
Použitie
Bezvodá forma sa používa ako katalyzátor pri Friedel-Craftsovej alkylácii (používa sa aj bezvodý chlorid hlinitý).
Podobné látky
- Chlorid hlinitý
- Jodid hlinitý
- Bromid boritý
- Bromid železitý
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Bromid hlinitý na českej Wikipédii.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.



