Žieravina
Žieravina alebo žieravá látka alebo korozívna látka je chemická látka, ktorá môže zničiť alebo nezvratne poškodiť inú látku, s ktorou príde do styku. Žieraviny sú nebezpečné najmä pre možnosť poškodenia očí, kože alebo podkožného tkaniva, vdychovanie alebo požitie žieraviny môže poškodiť dýchacie, resp. tráviace ústrojenstvo. Expozícia žieravinou vedie k poleptaniu.

Žieraviny sa v rámci bezpečnostnej klasifikácie označujú písmenom „C“ a nasledujúcim piktogramom:

Globálny harmonizovaný systém klasifikácie a označovania chemikálií (GHS) používa pre žieraviny tento piktogram:

Termín
Pod vplyvom angličtiny sa niekedy objavuje označenie korozívna látka (pôvodom z corrosive substance).
Žieraviny v nízkej koncentrácii sú obvykle dráždivé. Označenie látky symbolom „žieravý“ (GHS05) v Globálne harmonizovanom systéme môže byť založené ako na žieravosti pre živé tkanivá, aj pre neživé materiály (napr. kovy).
Žieraviny sa líšia od iných škodlivín tým, že sú pri styku s tkanivami bezprostredne nebezpečné, zatiaľ čo jedy majú systémový toxický účinok, ktorý potrebuje určitý čas k tomu, aby sa prejavil. Kolokviálne možno žieraviny označovať ako „jedy“, ale technicky ide o odlišné pojmy. Neexistuje nič, čo by bránilo tomu, aby žieravina bola súčasne aj jedom, teda existujú látky, ktoré sú aj žieravé aj jedovaté (napr. fenol).
Žieravosť

Typickými žieravinami sú silné kyseliny, zásady, alebo koncentrované roztoky niektorých slabých kyselín a zásad. Ich účinok na živé tkanivo je založený na acidobazickej katalýze hydrolýzy esterov a amidov. Žieravé kyseliny a zásady sú schopné odtučňovať kožu katalýzou hydrolýzy tukov, ktoré chemicky patria medzi estery. Bielkoviny sú chemicky amidy, ktoré môžu byť tiež hydrolyzované touto cestou. Silné kyseliny a zásady denaturujú bielkoviny a ľahko hydratujú. Hydratácia odstraňuje vodu z tkaniva a je významne exotermická. Napríklad koncentrovaná kyselina sírová pôsobí okrem poleptania tiež popáleniny. Silné oxidačné činidlá, napríklad koncentrovaný peroxid vodíka, môžu byť tiež žieravé pre tkaniny alebo iné materiály, aj keď je ich hodnota pH blízka neutrálnej. Príkladom silnej kyseliny, ktorá je súčasne silným oxidantom, je kyselina dusičná. Je výrazne žieravejšia, než by sa dalo očakávať podľa hodnoty pKa.
Existujú aj špecifickejšie žieraviny. Napríklad kyselina fluorovodíková pôsobí v nižších koncentráciách bezbolestne, ale ľahko preniká tkanivom a selektívne napadá kosti, čo robí prácu s ňou extrémne nebezpečnou. Technicky je to slabá kyselina, ale tvorí fluoridový ión (pôvodca žieravosti) potom, čo je bezbolestne vstrebaná. Roztoky chloridu zinočnatého sú normálne kyslé (podľa Brønstedovej definície), no zinkový katión špecificky napadá aj hydroxylové skupiny ako Lewisová kyselina. To vysvetľuje schopnosť chloridu zinočnatého reagovať s celulózou a poškodzovať papier a hodváb.
Bežné typy žieravín
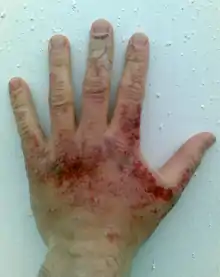
Bežné žieravé chemikálie možno rozdeliť na:
- kyseliny
- silné kyseliny – najobvyklejšie sú kyselina sírová (H2SO4), kyselina dusičná (HNO3) a kyselina chlorovodíková (HCl)
- niektoré koncentrované slabé kyseliny, napríklad kyselina octová
- roztoky Lewisových kyselín so špecifickou reaktivitou, napr. roztoky chloridu zinočnatého
- zásady
- hydroxidy (luhy), napríklad hydroxid sodný (NaOH) alebo hydroxid draselný (KOH)
- alkalické kovy v kovovej forme (napr. elementárny sodík) a ako hydridy, ďalej hydráty kovov zásaditých zemín (napr. hydroxid vápenatý)
- niektoré koncentrované slabé zásady, napríklad bezvodý amoniak alebo jeho koncentrované roztoky
- dehydratujúce činidlá, napríklad oxid fosforečný, oxid vápenatý, bezvodý chlorid zinočnatý, tiež elementárne alkalické kovy
- silné oxidanty, napríklad koncentrovaný peroxid vodíka
- elektrofilné halogény: elementárny fluór, chlór, bróm a jód, elektrofilné soli ako chlórnan sodný alebo N-chlórové zlúčeniny ako chloramín-T[1]; halogenidové ióny niesu žieravé
- organické halogenidy a organické kyseliny halogenidov, napríklad acetylchlorid a benzylchlóroformát
- anhydridy kyselín
- alkylačné činidlá, napríklad dimetylsulfát
- niektoré organické látky, napríklad fenol ("kyselina karbolová")
Referencie
- International Chemical Safety Card for Chloramine-T [online]. 18.10.2005, [cit. 2012-02-03]. Dostupné online. (anglicky)
Zdroj
- Tento článok je čiastočný alebo úplný preklad článku Žíravina na českej Wikipédii.