Kovalentná väzba
Kovalentná väzba (z lat. co- = súčasne, valere = vládnuť) je typ chemickej väzby, ktorá vzniká medzi dvoma atómami, ktoré majú jeden alebo viac nespárených elektrónov a ich rozdiel elektronegativít je malý. Kovalentná väzba je silnejšia ako vodíková väzba a je približne rovnako silná ako iónová väzba.
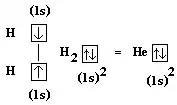
Pri tvorení väzby sa elektrónové oblaky nespárených elektrónov navzájom prekryjú a splynú. Spoločný elektrónový oblak sprostredkuje väzbu medzi atómami. Tým si atómy doplnia počet elektrónov zvyčajne na taký, aký majú atómy najbližšieho vzácneho plynu v periodickej tabuľke.
Polarita väzby
Na základe rozdielu elektronegativít-(X) prvkov tvoriacich väzbu rozlišujeme polárnu a nepolárnu kovalentnú väzbu. Polárna väzba je tvorená prvkami, ktorých rozdiel elektronegativít je väčší ako 0,4 a menší než 1,67. Pri nepolárnej väzbe musí byť hodnota tohto rozdielu menšia ako 0,4. Väzby s rozdielom elektronegativít vačším ako 1,67 nazývame iónové väzby.
Príklad
Napríklad zlúčením dvoch atómov vodíka vzniká molekula vodíka H2, v ktorej je spoločný dvojelektrónový orbitál patriaci obidvom atómom. Pri vodíku sa prekrývajú dva orbitály typu s (s—s). Oba atómy majú potom taký elektrónový obal ako atóm najbližšieho vzácneho plynu - hélia.
Podobne môže vzniknúť väzbový molekulový orbitál prekrytím a splynutím jednoelektrónových orbitálov p—p, ako je to napríklad pri zlučovaní dvoch atómov chlóru na molekulu Cl2. Splynutím jedného orbitálu s a jedného orbitálu p môže vzniknúť napríklad kovalentná väzba medzi vodíkom a chlórom - vzniká chlorovodík (HCl).
Pri vzniku zlúčenín kovov vedľajších podskupín sa uplatňujú pri tvorení kovalentnej väzby aj orbitály d predposlednej elektrónovej vrstvy, takže môžu vznikať väzbové molekulové orbitály s—d, p—d, d—d.
História objavu
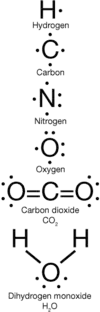
Objav kovalentnej väzby sa pripisuje Gilbertovi Lewisovi, ktorý v roku 1916 opísal poskytovanie elektrónového páru medzi atómami. Predstavil Lewisov zápis alebo Elektrónový bodový zápis, v ktorom sú valenčné elektróny (vo vonkajšej elektrónovej vrstve atómu) zakreslené ako body okolo atómu. Páry elektrónov nachádzajúce sa medzi atómami predstavujú kovalentné väzby. Viacnásobné páry reprezentujú viacnásobné väzby - dvojitú alebo trojitú.
Pre pochopenie kovalentnej väzby je potrebné poznať kvantovú mechaniku. Walter Heitler a Fritz London ako prví v roku 1927 úspešne popísali kvantovo-mechanický model kovalentnej väzby v molekule vodíka. Ich práca bola založená na valenčných väzbových modeloch.
Väzbovosť
Pri kovalentných zlúčeninách nehovoríme o mocenstve prvkov, ale o ich väzbovosti. Atóm prvku je toľkoväzbový, koľko kovalentných väzieb tvorí. V štruktúrnych vzorcoch zvýrazňujeme kovalentnú väzbu spojovníkom:
- H — H
- atóm vodíka je jednoväzbový
- Cl — Be — Cl
- atóm berýlia je dvojväzbový, atómy chlóru sú jednoväzbové
| Chemický portál |