Chlorid lantanitý
Chlorid lantanitý (LaCl3) je anorganická zlúčenina lantánu a chlóru. Vytvára tiež heptahydrát so vzorcom LaCl3• 7 H2O. Jedná sa o bielu pevnú látku dobre rozpustnú v vode a alkoholoch.
| Chlorid lantanitý | |||||||||||||||||||||||||||||||||
 Chlorid lantanitý | |||||||||||||||||||||||||||||||||
_2.png.webp) Chlorid lantanitý | |||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||
| Sumárny vzorec | LaCl3 (bezvodý) LaCl3•7 H2O (heptahydrát) | ||||||||||||||||||||||||||||||||
| Vzhľad | Biely hygroskopický prášok bez zápachu | ||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 245,3 u (bezvodý) 371,4 u (heptahydrát) | ||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 245,26 g/mol (bezvodý) 371,37 g/mol (heptahydrát) | ||||||||||||||||||||||||||||||||
| Teplota topenia | 858 °C | ||||||||||||||||||||||||||||||||
| Teplota varu | 1 000 °C | ||||||||||||||||||||||||||||||||
| Hustota | 3,840 g/cm3 | ||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: veľmi dobre rozpustný v polárnych rozpúšťadlách: rozpustný v etanole (heptahydrát) | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||
| Číslo CAS | 10099-58-8 (bezvodý) 20211-76-1 (heptahydrát) | ||||||||||||||||||||||||||||||||
| Číslo UN | 3260 | ||||||||||||||||||||||||||||||||
| Číslo RTECS | OE4375000 | ||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||
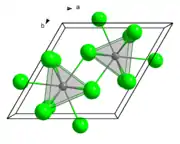
Štruktúra
Štruktúra chloridu lantanitého je podobná štruktúre chloridu uranitému.
Výroba
Chlorid lantanitý vzniká zlučovaním prvkov lantánu a chlóru:
- 2 La + 3 Cl2 → 2 LaCl3,
ale oveľa častejšie sa používa zahrievanie zmesi oxidu lantanitého s chloridom amónnim pri teplote 200-250 °C:[1]
- La2O3 + 6 NH4Cl → 2 LaCl3 + 6 NH3 + 2 H2O .
Z chloridu sa potom dajú pripraviť ďalšie halogenidy LaIII+. Pri redukcii draslíkom sa vytvára kovový lantán.
Použitie
Chlorid lantanitý nemá veľa spôsobov použitia, používa sa napríklad na zrážanie fosforečnanov z roztokov, napríklad v bazénoch za účelom prevencie rastu rias.
V organickej syntéze sa chlorid lantanitý používa ako slabá Lewisova kyselina pre prevod aldehydov na acetály.
Tiež sa používa ako katalyzátor pre oxidačnú chloráciu metánu na chlórmetán za použitia kyseliny chlorovodíkovej a kyslíka.
Taktiež je používaný v detektoroch gama žiarenia.
Referencie
- Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chlorid lanthanitý na českej Wikipédii.




