Chlorid dusitý
Chlorid dusitý (NCl3, iné názvy: trichlóramín, trichlórnitrid, chlorodusík) je anorganická zlúčenina. Táto žltá, olejovitá, štipľavo páchnuca kvapalina je najrozšírenejším vedľajším produktom reakcií medzi derivátmi amoniaku a chlórom (napríklad v plaveckých bazénoch pri reakcii moču plavcov s chlórom, ktorý sa do vody pridáva kvôli dezinfekcii).
| Chlorid dusitý | ||||||||||||||||||||||||
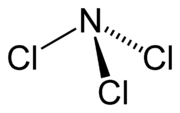 Chlorid dusitý | ||||||||||||||||||||||||
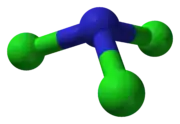 Chlorid dusitý | ||||||||||||||||||||||||
| Všeobecné vlastnosti | ||||||||||||||||||||||||
| Sumárny vzorec | NCl3 | |||||||||||||||||||||||
| Synonymá | trichlóramín trichlórnitrid chlorodusík | |||||||||||||||||||||||
| Vzhľad | žltá olejovitá kvapalina | |||||||||||||||||||||||
| Fyzikálne vlastnosti | ||||||||||||||||||||||||
| Molekulová hmotnosť | 120,4 u | |||||||||||||||||||||||
| Molárna hmotnosť | 120,365 g/mol | |||||||||||||||||||||||
| Teplota topenia | −40 °C | |||||||||||||||||||||||
| Teplota varu | 71 °C | |||||||||||||||||||||||
| Hustota | 1,635 g/cm³ | |||||||||||||||||||||||
| Rozpustnosť | vo vode: takmer nerozpustný (pomalá hydrolýza) | |||||||||||||||||||||||
| Termochemické vlastnosti | ||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | +232 kJ/mol | |||||||||||||||||||||||
| ||||||||||||||||||||||||
| Ďalšie informácie | ||||||||||||||||||||||||
| Číslo CAS | 10025-85-1 | |||||||||||||||||||||||
| EINECS číslo | 233-045-1 | |||||||||||||||||||||||
| Číslo RTECS | QW974000 | |||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | ||||||||||||||||||||||||
V čistej forme je chlorid dusitý vysoko reaktívny. V malých množstvách môže vznikať pri dezinfekcii pitnej vody monochlóramínom, vyššie hladiny môžu dráždiť sliznice.[1] Chlorid dusitý vyrábaný pod obchodnou značkou Agen sa používal na bielenie a dozrievanie múky. Má rovnaký účinok ako slzný plyn, ale nikdy nebol na tento účel používaný.[2]
Príprava a štruktúra
Zlúčenina sa pripravuje pôsobením chlóru na amónne soli, ako napríklad dusičnan amónny:
- 4 NH3 + 3 Cl2 → NCl3 + 3 NH4Cl
Medziprodukty v tejto konverzii sú chlóramín a dichlóramín (NH2Cl, resp. NHCl2).
Podobne ako amoniak, aj chlorid dusitý má pyramídovú molekulu.
Reakcia
Oxidačné číslo dusíka v chloride dusitom sa často uvažuje ako +3, atómy chlóru potom majú oxidačné číslo −1. Väčšina reaktívnych vlastností je s týmto popisom konzistentné.
Chlorid dusitý sa v horúcej vode hydrolyzuje na amoniak a kyselinu chlórnu: NCl3 + 3 H2O → NH3 + 3 HClO
Bezpečnosť
Chlorid dusitý je nebezpečná výbušnina. Je citlivý na svetlo, teplo a prítomnosť organických zlúčenín. Pierre Louis Dulong ho prvýkrát pripravil v roku 1812, pri dvoch explóziách prišiel o dva prsty a oko. Následkom výbuchu chloridu dusitého bol dočasne oslepený Sir Humphry Davy, ktorý preto zamestnal ako svojho spolupracovníka Michaela Faradaya. Belgickí vedci ohlásili možné spojenie medzi chloridom dusitým a vzostupom počtu prípadov astmy u detí, čo nazvali hypotézou bazénového chlóru. [3]
Podobné látky
- Bromid dusitý
- Fluorid dusitý
- Jodid dusitý
- Chlorid arzenitý
- Chlorid fosforitý
- Monochlóramín
- Dichlóramín
- Oxychlorid dusný
Referencie
- National Institute for Occupational Safety and Health. (2008, August). NIOSH eNews , 6 (4). Retrieved August 27, 2008, from http://www.cdc.gov/niosh/enews/enewsV6N4.html
- George Clifford White: The handbook of chlorination and alternative disinfectants. 4th Edition, Wiley, 1999, ISBN 978-0-471-29207-4, p 322
- Bernard A, Carbonnelle S, de Burbure C, Michel O, Nickmilder M. Chlorinated pool Attendance, Atop, and the risk of asthma during childhood. Environmental Health Perspectives , 2006, roč.114, čís. 10, s 1567-1573. Dostupné online. DOI:10.1289/ehp.8461. PMID 17035144
Literatúra
- Janderu, J. (1976). Adv. Inorg. Chem. Radiochem. 19:2.
- P. Kovacic; M. K. Lowery; K. W. Field. Chemistry of N-bromamines and N-chloramines. Chemical Reviews, 1970, roč. 70, čís. 6, s. 639. DOI: 10.1021/cr60268a002.
- Hartl, H.; Schoner, J.; Jander, J.; Schulz, H. Structure of Solide Nitrogen-Trichloride (-125 °C). Zeitschrift für Anorganische und Allgemeine Chemie, 1975, roč. 413, čís. 1, s. 61–71. DOI: 10.1002/zaac.19754130108.
- Cazzoli, G.; Favero, P. G.; Dalborgo, A.. Molecular-Structure, Nuclear-Quadruple Coupling-Constant and Dipole-Moment of Nitrogen Trichloride from Microwave Spectroscopy. Journal of Molecular Spectroscopy, 1974, roč. 50, čís. 1-3, s. 82. DOI: 10.1016/0022-2852(74)90219-7.
- Bayersdo, L.; Engelhar, U.; Fischer, J.; Hohne, K.; Jander, J. Nitrogen-chlorine compounds: Infrared spectra and Raman spectra of nitrogen trichloride. Zeitschrift für anorganische und allgemeine Chemie, 1969, roč. 366, čís. 3-4, s. 169-. DOI: 10.1002/zaac.19693660308.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chlorid dusitý na českej Wikipédii.
