Butan-1-ol
Butan-1-ol, také nazývaný n-butanol, je primární alkohol se vzorcem C4H9OH a lineární strukturou. Jeho izomery jsou isobutanol, butan-2-ol a terc-butanol. Samotný název butanol se obvykle používá pro nerozvětvený primární izomer.
| Butan-1-ol | |
|---|---|
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | butan-1-ol |
| Ostatní názvy | n-butanol |
| Funkční vzorec | CH3(CH2)2CH2OH |
| Sumární vzorec | C4H10O |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 71-36-3 |
| EC-no (EINECS/ELINCS/NLP) | 200-751-6 |
| PubChem | 263 |
| ChEBI | 28885 |
| SMILES | OCCCC |
| InChI | 1S/C4H10O/c1-2-3-4-5/h5H,2-4H2,1H3 |
| Číslo RTECS | EO1400000 |
| Vlastnosti | |
| Molární hmotnost | 74,122 g/mol |
| Teplota tání | −89,8 °C (183,4 K)[1] |
| Teplota varu | 117,7 °C (390,8 K)[1] |
| Hustota | 0,8098 g/cm3 (20 °C)[1] |
| Disociační konstanta pKa | 16,1[1] |
| Rozpustnost ve vodě | 6,32 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v acetonu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v diethyletheru[1] |
| Tlak páry | 0,58 kPa (20 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H226 H302 H315 H318 H335 H336[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264 P270 P271 P280 P301+312 P302+352 P303+361+353 P304+340 P305+351+338 P310 P312 P321 P330 P332+313 P362 P370+378 P403+233 P403+235 P405 P501[1] |
| Teplota vznícení | 343 °C (616 K)}[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Butan-1-ol vzniká jako vedlejší produkt ethanolového kvašení sacharidů[2] a nachází se v řadě potravin a nápojů.[3][4] Používá se jako ochucovadlo[5] v máslu, smetaně, ovoci, rumu, whiskey, zmrzlině, cukrovinkách, pečivu a likérech.[6][3]
Nejvíce se butan-1-ol jako meziprodukt v chemickém průmyslu, například na výrobu butylacetátu (používaného také jako ochucovadlo; i jako průmyslové rozpouštědlo). Vyrábí se z propenu získávaného z ropy.
Výroba
Od 50. let 20. století se butan-1-ol vyrábí především hydroformylací propenu (nazývaným také oxo proces), kdy je hlavním produktem butyraldehyd (n-butanal) katalyzátory jsou obvykle odvozeny od kobaltu nebo rhodia. Butyraldehyd se následně hydrogenuje za vzniku butanolu.
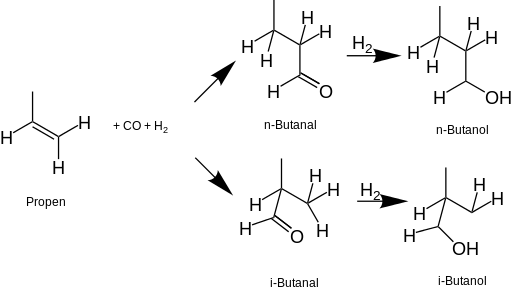
Dalším způsobem výroby butanolu je Reppeova reakce propenu s oxidem uhelnatým a vodou:[7]
- CH3CH=CH2 + H2O + 2 CO → CH3CH2CH2CH2OH + CO2
V minulosti se butanol vyráběl z krotonaldehydu, jenž se získával z acetaldehydu.
Butanol může také vznikat kvašením působením bakterií. Před 50. léty 20. století se k průmyslové výrobě butanolu používala bakterie Clostridium acetobutylicum. Bylo zjištěno, že i jiné mikroorganismy mohou tvořit butanol.
Použití
85 % butanolu se používá na výrobu laků. Jedná se o často používané rozpouštědlo, například u nitrocelulózy. Jako rozpouštědla slouží také řada látek jako je 2-butoxyethanol. Na butylesterech je založeno mnoho změkčovadel, například dibutylftalát. Butylakrylát se používá na výrobu polymerů. Butanol také slouží jako prekurzor n-butylaminů.[7]
Biopalivo
Butan-1-ol byl navržen jako náhrada nafty a benzínu. V malých množstvích vzniká v téměř všech kvasných procesech a ve velkém množství jej vytváří bakterie rodu Clostridium. Výzkum se zaměřuje především na získávání většího množství butanolu z biomasy.
V motorech určených pro používání benzinu lze jako palivo použít až 85% butanol, aniž by bylo třeba přestavovat motor (což není možné u 85% ethanolu), navíc poskytuje ze stejného objemu více energie než ethanol, protože obsahuje méně kyslíku,[8] množství uvolněné energie je téměř stejné jako u benzinu. Butanol lze také přidávat do nafty za účelem snížení množství sazí.[9]
U následujících materiálů může výroba, někdy i používání, způsobit vystavení butan-1-olu: u syntetických kůží, butylesterů, barev, ovocných vůní, laků, fotografických filmů, pláštěnek, parémů, pyroxylinových plastů, viskózových vláken, bezpečnostních skel a vodě odolného oblečení.[3]
Výskyt
Butan-1-ol vzniká kvašením cukrů v řadě různých alkoholických nápojů, jako jsou pivo,[10] vinné pálenky,[11] víno[12] a whiskey.[13]
Byl také nalezen mezi těkavými látkami v chmelu,[14] plodů chlebovníku různolistém,[15] tepelně ošetřeném mléku,[16] melounu cukrovém,[17] v sýrech,[18] semenech rostliny Vigna unguiculata[19] a vařené rýži.[20]
Butanol také vzniká při smažení v kukuřičném a bavlněném oleji, linoleinu a trioleinu.[21]
Butan-1-ol je přirozenou složkou řady alkoholických nápojů, i když jsou jeho koncentrace nízké a proměnlivé.[22][23]
Butanol se považuje za příčinu některých případů těžké kocoviny, i když experimenty na zvířecích modelech tento vliv nepotvrdily.[24]
Butan-1-ol se také používá na výrobu ochucovadel[25] a k extrakci bezlipidových bílkovin z vaječného žloutku,[26] také k získávání chmelových extraktů extraktů a jako rozpouštědlo při odstraňování pigmentů z koncentrátů listových bílkovin.[27]
Metabolismus a toxicita
Akutní toxicita butanolu je nízká, LD50 při ústním podání je u krys 790–4360 mg/kg (u ethanolu činí 7000–15 000 mg/kg).[4][7] U obratlovců je metabolizován podobně jako ethanol: alkoholdehydrogenáza jej přeměňuje na butyraldehyd, ze kterého se poté působením aldehyddehydrogenázy stává kyselina máselná. Kyselina máselná může být metabolizována až na oxid uhličitý a vodu v beta oxidaci. U krys se při dávce 2000 mg/kg pouze 0,03 % vyloučilo močí.[28] Při subletálních dávkách butan-1-ol, podobně jako ethanol, utlumuje činnost centrální nervové soustavy: schopnost vyvolat otravu je u butanolu přibližně šestinásobná oproti ethanolu, pravděpodobně v důsledku pomalejší přeměny alkoholdehydrogenázou.[29]
Ostatní nebezpečí
Kapalný butan-1-ol je, podobně jako většina organických rozpouštědel, značně dráždivý vůči očím; podráždění může být vyvoláno i opakovaným stykem s kůží.[4] Zvýšení citlivosti kůže pozorováno nebylo. K podráždění dýchací soustavy dochází pouze při vysokých koncentracích (nad 2400 ppm).[30]
Vzhledem k teplotě vzplanutí 35 °C se butan-1-ol řadí mezi středně nebezpečné hořlaviny; je o něco hořlavější než petrolej nebo nafta, ovšem méně než mnohá běžná organická rozpouštědla. Utlumení centrální nervové soustavy způsobované touto látkou (podobné otravě ethanolem) může představovat určité nebezpečí při práci v uzavřených prostorech, i když je cítit při koncentracích 0,2 až 30 ppm, které jsou příliš nízké na to, aby mohly působit na nervovou soustavu.[30][31]
Odkazy
Související články
- Butanolové palivo
Reference
V tomto článku byl použit překlad textu z článku 1-Butanol na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/263
- Lucie A. Hazelwood; Jean-Marc Daran; Antonius J. A. van Maris; Jack T. Pronk; J. Richard Dickinson. The Ehrlich pathway for fusel alcohol production: a century of research on Saccharomyces cerevisiae metabolism. Applied and Environmental Microbiology. 2008, s. 2259–2266. DOI 10.1128/AEM.02625-07. PMID 18281432. Bibcode 2008ApEnM..74.2259H.
- Šablona:EHC-ref.
- Šablona:SIDS-ref.
- 21 C.F.R. § 172.515; 42 FR 14491, Mar. 15, 1977, as amended.
- HALL, R. L.; OSER, B. L. Recent progress in the consideration of flavouring ingredients under the food additives amendment. III. Gras substances. Food Technology. 1965, s. 151. (anglicky)Šablona:EHC-ref
- Šablona:Ullmann
- Schmidt-Rohr, K. (2015). "Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2", J. Chem. Educ. 92: 2094-2099. https://dx.doi.org/10.1021/acs.jchemed.5b00333
- D. Antoni; V. Zverlov; W. H. Schwarz. Biofuels from Microbes. Applied Microbiology and Biotechnology. 2007, s. 23–35. DOI 10.1007/s00253-007-1163-x. PMID 17891391.
- W. Bonte. Congener substances in German and foreign beers. Blutalkohol. 1979, s. 108–124.
- Peter Schreier; Friedrich Drawert; Friedrich Winkler. Composition of neutral volatile constituents in grape brandies. Journal of Agricultural and Food Chemistry. 1979, s. 365–372. DOI 10.1021/jf60222a031.
- W. Bonte. Congener content of wine and similar beverages. Blutalkohol. 1979, s. 392–404.
- W. Postel; L. Adam. Gas chromatographic characterization of whiskey. III. Irish whiskey. Branntweinwirtschaft. 1978, s. 404–407.
- Roland Tressl; Lothar Friese; Friedrich Fendesack; Hans Koeppler. Studies of the volatile composition of hops during storage. Journal of Agricultural and Food Chemistry. 1978, s. 1426–1430. DOI 10.1021/jf60220a036.
- G. Swords; P. A. Bobbio; G. L. K. Hunter. Volatile constituents of jack fruit (Arthocarpus heterophyllus). Journal of Food Science. 1978, s. 639–640. DOI 10.1111/j.1365-2621.1978.tb02375.x.
- Haytham A. Jaddou; John A. Pavey; Donald J. Manning. Chemical analysis of flavor volatiles in heat-treated milks. Journal of Dairy Research. 1978, s. 391–403. DOI 10.1017/S0022029900016617.
- K. Yabumoto; K. Yamaguchi; W. G. Jennings. Production of volatile compounds by Muskmelon, Cucumis melo. Food Chemistry. 1978, s. 7–16. DOI 10.1016/0308-8146(78)90042-0.
- Jean Pierre Dumont; Jacques Adda. Occurrence of sesquiterpones in mountain cheese volatiles. Journal of Agricultural and Food Chemistry. 1978, s. 364–367. DOI 10.1021/jf60216a037.
- Gordon S. Fisher; Michael G. Legendre; Norman V. Lovgren; Walter H. Schuller; John A. Wells. Volatile constituents of southernpea seed [Vigna unguiculata (L.) Walp.. Journal of Agricultural and Food Chemistry. 1979, s. 7–11. DOI 10.1021/jf60221a040.
- Izumi Yajima; Tetsuya Yanai; Mikio Nakamura; Hidemasa Sakakibara; Tsutomu Habu. Volatile flavor components of cooked rice. Agriculture and Biological Chemistry. 1978, s. 1229–1233. Dostupné online. DOI 10.1271/bbb1961.42.1229.
- S. S. Chang; K. J. Peterson; C. Ho. Chemical reactions involved in the deep-fat frying of foods. Journal of the American Oil Chemists' Society. 1978, s. 718–727. DOI 10.1007/BF02665369. PMID 730972.
- Kang-Lyung Woo. Determination of low molecular weight alcohols including fusel oil in various samples by diethyl ether extraction and capillary gas chromatography. Journal of AOAC International. 2005, s. 1419–1427. DOI 10.1093/jaoac/88.5.1419. PMID 16385992.
- Dirk W. Lachenmeier; Simone Haupt; Katja Schulz. Defining maximum levels of higher alcohols in alcoholic beverages and surrogate alcohol products. Regulatory Toxicology and Pharmacology. 2008, s. 313–321. DOI 10.1016/j.yrtph.2007.12.008. PMID 18295386.
- Hisako Hori; Wataru Fujii; Yutaka Hatanaka; Yoshihide Suwa. Effects of fusel oil on animal hangover models. Alcoholism: Clinical and Experimental Research. 2003, s. 375–415. DOI 10.1097/01.ALC.0000078828.49740.48. PMID 12960505.
- I. Mellan. Industrial Solvents. New York: Van Nostrand Reinhold, 1950. Dostupné online. S. 482-488.
- Harry W. Meslar; Harold B. White. Preparation of lipid-free protein extracts of egg yolk. Analytical Biochemistry. 1978, s. 75–81. DOI 10.1016/0003-2697(78)90817-5. PMID 9762085.
- Walter J. Bray; Catherine Humphries. Solvent fractionation of leaf juice to prepare green and white protein products. Journal of the Science of Food and Agriculture. 1978, s. 839–846. DOI 10.1002/jsfa.2740291003.
- GAILLARD, D.; DERACHE, R. Métabilisation de différents alcools présents dans les biossons alcooliques chez le rat. Trav. Soc. Pharmacol. Montpellier. 1965, s. 541–562. (anglicky)
- MCCREERY, N. J.; HUNT, W. A. Physico-chemical correlates of alcohol intoxication. Neuropharmacology. 1978, s. 451–61. DOI 10.1016/0028-3908(78)90050-3. PMID 567755. (anglicky).
- C J. Wysocki; P. Dalton. Odor and Irritation Thresholds for 1-Butanol in Humans. [s.l.]: JMonell Chemical Senses Center, 1996.
- J. Enrique Cometto-Muñiz; William S. Cain. Trigeminal and Olfactory Sensitivity: Comparison of Modalities and Methods of Measurement. International Archives of Occupational and Environmental Health. 1998, s. 105–110. Dostupné online. DOI 10.1007/s004200050256. PMID 9580447.


