Vazba uhlík–vodík
Vazba uhlík-vodík (C–H) je kovalentní vazba mezi atomy uhlíku a vodíku; vyskytuje se v mnoha organických sloučeninách. Jeden uhlík může sdílet své valenční elektrony až se čtyřmi atomy vodíku, čímž atomy dosáhnou elektronové konfigurace vzácného plynu.[1] Obvyklé délky těchto vazeb jsou okolo 109 pm (1,09 × 10−10 m) a vazebné energie kolem 413 kJ/mol (viz tabulku níže). Vzhledem k tomu, že elektronegativita má u C hodnotu 2,55 a u H 2,2, tak se vazby C−H v důsledku malých rozdílů elektronegativity mezi vázanými atomy obvykle považují za nepolární. Ve strukturních vzorcích organických sloučenin se atomy vodíku často nezobrazují. Ke sloučeninám obsahujícím pouze vazby C–H a C–C patří alkany, alkeny, alkyny a areny, sloučeniny souhrnně označované jako uhlovodíky.
V říjnu 2016 bylo zjištěno, že základní chemické složky života, konkrétně molekula CH, také nazývaná methylidynový radikál a ionty CH+ a C+, zaznamenané ve vesmírném prostoru, vznikají převážně působením ultrafialového záření z hvězd namísto ostatních možných způsobů, jako jsou výsledky turbulentních událostí souvisejících se supernovami a mladými hvězdami, jak se předpokládalo dříve.[2]
Délka vazeb
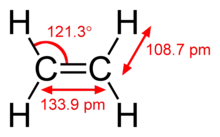
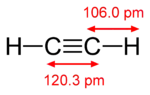
Délka vazeb uhlík-uhlík se mírně liší v závislosti na hybridizaci orbitalů uhlíkového atomu. Vazby mezi vodíkem a sp2 hybridizovanými uhlíky jsou přibližně o 0,6 % kratší, než když je uhlík sp3 hybridizován. Vazby mezi uhlíkém a sp hybridizovaným uhlíkem jsou asi o 3 % kratší než u sp3 C-H. Tento trend může být znázorněn na molekulových geomnetriích ethanu, ethenu a ethynu.
| Molecule | Ethan | Ethen | Ethyn |
|---|---|---|---|
| Vzorec | C2H6 | C2H4 | C2H2 |
| Skupina | alkany | alkeny | alkyny |
| Struktura |  |
 |
 |
| Hybridizace uhlíkových atomů | sp3 | sp2 | sp |
| délka vazby C-H | 109,4 pm | 108,7 pm | 106,0 pm |
| Poměr délky vazby vzhledem k ethanu | 100% | 99% | 97% |
| Metoda určeni struktury | mikrovlnná spektroskopie | mikrovlnná spektroskopie | infračervená spektroskopie |
Reakce
Vazby C−H jsou velmi silné, takže i málo reaktivní. U některých sloučenin, souhrnně označovaných jako karbonové kyseliny, jsou vazby C−H dostatečně kyselé, aby mohlo dojít k odštěpení protonu. Neaktivované vazby C−H se vyskytují u alkanů, které neobsahují heteroatom (například O, N nebo Si). Tyto vazby se obvykle účastní pouze radikálových substitucí. Mnoho enzymů ovšem může katalyzovat i jiné jejich reakce.[4]
I když patří vazby C−H k nejsilnějším, tak se jejich energie u stabilních sloučenin, i za nepřítomnosti heteroatomů, liší až o 30 %.[5][6]
| Vazba | Uhlovodíkový radikál | Molární disociační energie vazby (kJ) |
|---|---|---|
| CH3−H | Methyl | 440 |
| C2H5−H | Ethyl | 410 |
| (CH3)2HC−H | Isopropyl | 400 |
| (CH3)3C−H | terc-butyl | 390 |
| CH2=CH−H | vinyl | 470 |
| HC≡C−H | ethynyl | 560 |
| C6H5−H | fenyl | 460 |
| CH2=CHCH2−H | Allyl | 370 |
| C6H5CH2−H | Benzyl | 360 |
| OC4H7−H | tetrahydrofuranyl | 380 |
| CH3C(O)CH2−H | acetonyl | 400 |
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Carbon–hydrogen bond na anglické Wikipedii.
- Life Sciences Cyberbridge [online]. [cit. 2015-09-15]. Dostupné v archivu pořízeném z originálu dne 2015-09-18. (anglicky)
- Elizabeth Landau. Building Blocks of Life's Building Blocks Come From Starlight [online]. NASA, 2016-10-12 [cit. 2016-10-13]. Dostupné online.
- CRC Handbook of Chemistry and Physics, 88th edition
- Bollinger, J. M. Jr., Broderick, J. B. "Frontiers in enzymatic C-H-bond activation" Current Opinion in Chemical Biology 2009, vol. 13, page 51-7. DOI:10.1016/j.cbpa.2009.03.018
- Bond Energies [online]. Dostupné online.
- Yu-Ran Luo and Jin-Pei Cheng "Bond Dissociation Energies" in CRC Handbook of Chemistry and Physics, 96th Edition