Vazba pí
Vazba pí (π) je kovalentní vazba, při níž se dva laloky jednoho atomového orbitalu překryjí se dvěma laloky orbitalu jiného atomu a spojnice středů jader vázaných atomů neprochází těmito překryvy. Na společné uzlové rovině, která prochází jádry vázaných atomů, je nulová elektronová hustota a tato rovina je i uzlovou rovinou molekulového orbitalu vzniklé vazby.

Řecké písmeno π odkazuje na orbitaly p, jelikož je orbitalová symetrie vazby pí stejná, jako u orbitalu p. Vazba π často vzniká mezi dvěma orbitaly p, ovšem mohou se na ní podílet i orbitaly d.
Vazby pí jsou většinou slabší než vazby sigma. Dvojná vazba mezi uhlíkovými atomy (C=C), složená z jedné vazby sigma a jedné vazby pí,[1] má nižší energii, než je dvojnásobek energie jednoduché vazby C-C, což naznačuje, že stabilita dodaná vazbou pí je nižší než stabilita dodaná vazbou sigma. Pomocí kvantové mechaniky lze tento rozdíl vysvětlit výrazně menším překryvem orbitalů p kvůli jejich paralelní orientaci, což je v kontrastu s vazbami sigma, kde vazebné orbitaly vznikají přímo mezi jádry atomů, čímž se vytváří větší překryv orbitalů a silnější vazba sigma. Vazba pí je výsledkem překrytí atomových orbitalů na dvou různých místech a je tak oproti vazbě sigma rozptýlenější.
Elektrony vazby π se často nazývají π elektrony. Části molekul spojené vazbou π nemohou kolem této vazby rotovat, aniž by došlo k jejímu zničení, jelikož by při rotaci došlo k narušení paralelní orientace příslušných orbitalů p.
U dvouatomových molekul prvků mají vazebné orbitaly π pouze jednu uzlovou rovinu, ta prochází vázanými atomy. Odpovídající protivazebný orbital π* je definován přítomností druhé uzlové roviny mezi vázanými atomy.
Vazba π ve vícenásobných vazbách
Běžná dvojná vazba, například vazba C=C v molekule ethenu, se skládá z jedné vazby sigma a jedné vazby pí. Běžná trojná vazba, například v ethynu, je složena z jedné vazby sigma a dvou vazeb pí, které se nacházejí v navzájem kolmých rovinách, ve kterých leží i osy vazeb. Mezi dvěma atomy mohou být nanejvýš dvě vazby pí. Čtverné vazby mohou vzniknout pouze mezi atomy přechodných kovů a skládají se z jedné vazby sigma, dvou vazeb pí a jedné vazby delta.
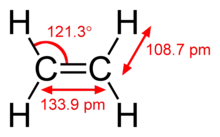
Vazba pí je slabší než vazba sigma, ovšem dvojná vazba z nich vzniklá je silnější než kterákoliv z těchto dílčích vazeb, což se nejvíce projevuje menší délkou vazby; například vazba C-C v molekule ethanu má délku 154 pm,[2][3] vazba C=C v ethenu má délku 134 pm a trojná vazba v ethenu pouze 120 pm, s rostoucí násobností se tedy snižuje délka vazby a zvyšuje její síla (vazebná energie).
 |
 |
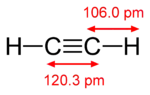 |
| ethan (1 vazba σ) | ethen (1 vazba σ a 1 vazba π) | ethyn (1 vazba σ a 2 vazby π) |
Zvláštní případy
Vazba pí může existovat i bez přítomnosti vazby sigma.
V některých komplexech kovů vznikají vazby π interakcemi atomu kovu s protivazebnými orbitaly π* alkenu či alkynu.
Některé vícenásobné vazby mezi dvěma atomy neobsahují vazbu σ, pouze vazby π. Příklady mohou být hexakarbonyl diželeza (Fe2(CO)6) a dvouatomový uhlík (C2); v těchto molekulách se dvojná vazba skládá pouze ze dvou vazeb pí. Uvedené látky byly použity jako modely k výpočetní analýze vazby pí, přičemž bylo zjištěno, že k dosažení maximálního překryvu orbitalů musejí být vazby mnohem kratší, než by se dalo očekávat.[4]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Pi bond na anglické Wikipedii.
- Andrew Streitwieser; Clayton H. Heathcock; Edward M. Kosower. Introduction to organic chemistry. [s.l.]: Macmillan, 1992. (4). Dostupné online. ISBN 0024181706. OCLC 24501305 S. 250. (anglicky)
- A. Veillard. Relaxation during internal rotation ethane and hydrogen peroxyde. Theoretica chimica acta. 1970, s. 21–23. (anglicky)
- Marlin D. Harmony. The equilibrium carbon–carbon single‐bond length in ethane. The Journal of Chemical Physics. 1990, s. 7522–7523. Bibcode 1990JChPh..93.7522H. (anglicky)
- Eluvathingal Devassy Jemmis; Biswarup Pathak; R. Bruce King; Henry F. Schaefer. Bond length and bond multiplicity: σ-bond prevents short π-bonds. Chemical Communications. 2006, s. 2164–2166. (anglicky)