Hyperkonjugace
Hyperkonjugace nastává při spojení alkylových skupin s násobnou vazbou. σ-vazby se mohou částečně chovat jako volné elektronové páry, které se konjugují se sousední vazbou π. Dochází ke zkrácení jednoduché vazby C-C v sousedství násobné vazby, tím se zvýší energie a stabilita jednoduché vazby. Velikost hyperkonjugace roste s počtem vodíku na uhlíku vedle násobné vazby.
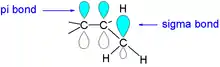
Hyperkonjugace
Vliv na chemické vlastnosti
Hyperkonjugace ovlivňuje několik důležitých vlastností:[1] [2]
- Vazebná délka: Hyperkonjugace je jedním z klíčových faktorů odpovědných za zkrácení vazby σ. Například vazba C-C v buta-1,3-dienu má délku 146 pm, což je podstatně méně než 154 pm u nasycených uhlovodíků.
- Dipólový moment: Velký nárůst dipólového momentu 1,1,1-trichlorethanu ve srovnání s chloroformem lze vysvětlit hyperkonjugací.
- Slučovací teplo hyperkonjugovaných molekul je vyšší než součet vazebných energií a hydrogenační teplo vztažené na jednu dvojnou vazbu je nižší než hydrogenační teplo ethenu.
- Stabilitu karbokationtů:
- (CH3)3C+ > (CH3)2CH+ > (CH3)CH2+ > CH3+
Reference
- DEASY, C.L. Hyperconjugation. Chem. Rev.. 1945, roč. 36, čís. 2, s. 145–155. DOI 10.1021/cr60114a001. (anglicky)
- DEWAR, M.J.S.; SCHMEISING, H.N. A re-evaluation of conjugation and hyperconjugation: The effects of changes in hybridisation on carbon bonds. Tetrahedron. 1959, roč. 5, čís. 2–3, s. 166–178. DOI 10.1016/0040-4020(59)80102-2. (anglicky)
Portály: Chemie
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.