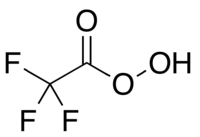
Kyselina trifluorperoctová
Kyselina trifluorperoctová je peroxokyselina odvozená od kyseliny trifluoroctové. Jedná se o silné oxidační činidlo, používané v organické chemii například při Baeyerově–Villigerově oxidaci ketonů.[1] Je nejreaktivnější ze všech organických peroxokyselin, což umožňuje oxidaci i poměrně málo reaktivních alkenů na epoxidy, kdy jsou ostatní peroxokyseliny neúčinné.[2] Lze ji také použít k oxidaci chalkogenů v některých funkčních skupinách, například při přeměně selenoetherů na selenony (selenových ekvivalentů thioetherů na ekvivalenty sulfonů).[3] Kyselina peroctová je potenciálně výbušná[4] a není komerčně dostupná, ovšem lze ji rychle připravit před použitím.[5] Její laboratorní používání zavedl a rozvinul William Emmons.[6][7]
| Kyselina trifluorperoctová | |
|---|---|
Strukturní vzorec | |
| Obecné | |
| Systematický název | kyselina trifluorperoxoethanová |
| Ostatní názvy | kyselina trifluorperoxooctová, kyselina trifluorperoxyoctová |
| Funkční vzorec | CF3C(O)OOH |
| Sumární vzorec | C2HF3O3 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 534-17-8 |
| PubChem | 10290812 |
| SMILES | C(=O)(C(F)(F)F)OO |
| InChI | 1/C2HF3O3/c3-2(4,5)1(6)8-7/h7H |
| Vlastnosti | |
| Molární hmotnost | 130,02 g/mol |
| Teplota varu | 162 °C (435 K) |
| Rozpustnost ve vodě | reaguje |
| Rozpustnost v polárních rozpouštědlech |
rozpustná v sulfolanu a acetonitrilu |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustná v dichlormethanu a diethyletheru |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vlastnosti
Při standardní teplotě a tlaku je kyselina trifluorperoctová bezbarvou kapalinou s teplotou varu 162 °C.[8] Rozpouští se v acetonitrilu, dichlormethanu, diethyletheru a sulfolanu a s vodou reaguje.[5] Stejně jako ostatní peroxokyseliny je potenciálně výbušnou látkou.[4] Není komerčně dostupná, ovšem lze ji skladovat několik týdnů za teploty −20 °C.[5] Při některých postupech přípravy této kyseliny se použivá směs peroxidu vodíku a kyseliny trifluoroctové, jejíž zahřívání je nebezpečné; peroxid vodíku lze rozložit pomocí oxidu manganičitého.[5][8]
Příprava
Kyselinu trifluorperoctovou je možné rychle připravit reakcí anhydridu kyseliny trifluoroctové s koncentrovaným (90%)[2] vodným roztokem peroxidu vodíku:
- CF3COOCOCF3 + H2O2 → CF3COOOH + CF3COOH
Jelikož se anhydrid při kontaktu s vodou mění na kyselinu trifluoroctovou, tak jeho přebytek slouží též k odstranění vody z peroxidu.:[9]
- CF3COOCOCF3 + H2O → 2 CF3COOH
K přípravě kyseliny trifluorperoctové z kyseliny trifluoroctové lze použít i zředěnější (30%) roztok peroxidu vodíku:[2]
- CF3COOH + H2O2 → CF3COOOH + H2O
Za účelem omezení nebezpečnosti skladování čistého či vysoce koncentrovaného peroxidu vodíku se často používá jeho směs s močovinou.[5] Při tomto postupu se nepoužívá voda, takže vzniká bezvodá kyselina,[10] čímž se zamezí vedlejším reakcím, které za její přítomnosti často probíhají.[11]
- CF3COOCOCF3 + H2O2·CO(NH2)2 → CF3COOOH + CO(NH2)2
Pokud je při přípravě nutné použití pufru a přítomost vody není na závadu, tak se používá jiný postup. Reakcí anhydridu kyseliny trifluoroctové s peruhličitanem sodným vzniká kyselina trifluorperoctová a uhličitan sodný, díky němuž není potřeba přidávat další pufr.[5][12]
- 3 CF3COOCOCF3 + 4 Na2CO3·1½ H2O2 → 6 CF3COOOH + 4 Na2CO3 + 3 H2O
Použití
iodo)benzene-3D-balls.png.webp)
Kyselina trifluorperoctová se používá převážně jako oxidační činidlo.[5][7] V září 1953 byla publikována práce Williama Emmonse a Arthura Ferrise, v níž bylo uvedeno, jak tato látka, vytvořená in situ, oxiduje anilin na nitrobenzen.[13] Během následujících dvou let popsal Emmons přípravu tohoto činidla a vytvořil šest dalších prací, ve kterých popisoval jeho použití.;[14][15][16] Emmons je považován za průkopníka[6][7] používání kyseliny trifluorperoctové, která je užitečným činidlem v mnoha druzích syntetzických reakcí, v laboratořích.
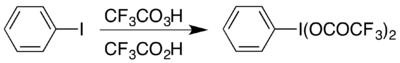
Příkladem použití může být vznik (bis(trifluoracetoxy)jod)benzenu (C6H5I(OOCCF3)2), který se používá k provedení Hofmannova přesmykuv kyselém prostředí.[17] Zmíněná sloučenina obsahuje hypervalentní jod a lze ji získat dvěma způsoby; výběr konkrétního způsobu záleží na dostupných materiálech: výměnnou reakcí jejího acetátového analogu[18] nebo reakcí jodbenzenu se sněsí kyseliny trifluorperoctové a trifluoroctové.[17]
Baeyerova–Villigerova oxidace
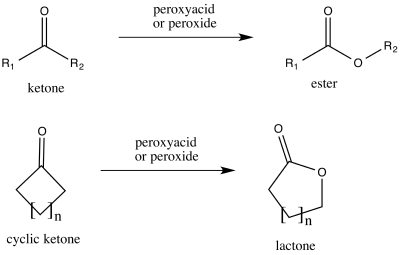
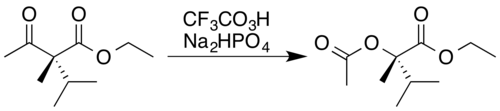
Kyselina trifluorperoctová je jedním z nejsilnějších činidel používaných při Baeyerově–Villigerově oxidaci, jelikož má vysokou kyselost srovnatelnou s obdobnými kyselinami a peroxidy.[19] Při této reakci, pojmenované podle Adolfovi von Baeyer a Victoru Villigerovi, kteří ji roku 1899 objevili,[1] se acyklické ketony oxidují na estery a cyklické ketony na laktony. Tato reakce má dobrou regioselektivitu a chemoselektivitu na místě, kde se objeví nový kyslíkový atom, a zachovává stereochemii na sousedním atomu, což je zobrazeno na následujícím obrázku. Do reakční směsi se přidává hydrogenfosforečnan sodný (Na2PO4) jako pufr[2] za účelem zabránění hydrolýze, kterou by způsobila vysoce kyselá kyselina trifluoroctová,[20] nebo transesterifikaci.[21] vzniklého esteru.
Epoxidace
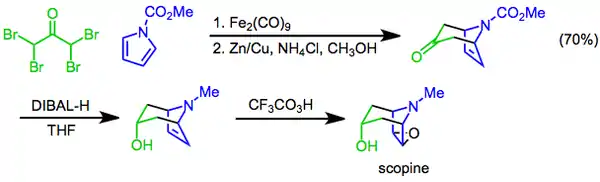
Při Priležajevově reakci,[22] spočívá v přeměně alkenu na epoxid při použití peroxokyseliny jako oxidačního činidla.[23] Příkladem může být syntéza tropanového alkaloidu skopinu, kdy je epoxidace kyslinou trifluorperoctovou závěrečným krokem následujícím po [4+3] cykloadici a diastereomerní redukcí hydridem diisobutylhlinitým.[24]
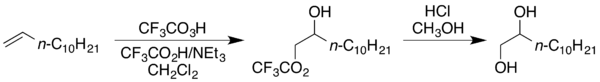
Vysoká reaktivita kyseliny trifluorperoctové oproti ostatním peroxokyselinám umožňuje účinně oxidovat alkeny a cykloalkeny s poměrně nízkou elektronovou hustotou, jako jsou mimo jiné hex-1-en a α,β-nenasycené estery (například methylmethakrylát), což jsou substráty, které většinou odolávají epoxidaci peroxidovými kyselinami.[2] Přidáním další pufrované kyseliny trifluoroctové do reakční směsi způsobuje vytvoření vicinální hydroxytrifluoracetátové struktury namísto epoxidu. Takovýto produkt lze převést na diol reakcí s methanolem v kyselém prostředí jako například při následující přeměně dodec-1-enu na dodekan-1,2-diol.[2]
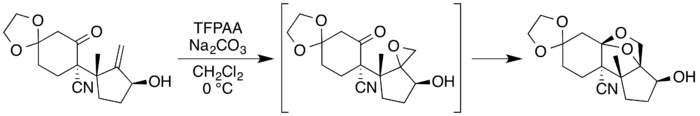
Při použití derivátu allylalkoholu s alkoholovou skupinou v sousedství karbonylu může u epoxidu dojít k rozšíření cyklu za vzniku dioxolanu.[5][11] Proces znázorněný na následujícím obrázku byl použit jako součást totální syntézy neosporolu:[11][25]
Postup přípravy izomerní sloučeniny sporolu zahrnuje podobnou tvorbu dioxolanu. Během tohoto procesu se poiužívá kyselina trifluorperoctová vytvořená z peroxidu vodíku, který může obsahovat stopová množství vody, která vede ke vzniku poloacetalu místo dioxolanu. Je-li k získání kyseliny použit komplex močoviny, z nějž vzniká čistá kyselina, pak je dioxolan hlavním produktem tohoto procesu.[11] Vytvořený dioxolan lte rozšířit na 1,3-dioxanovou skupinu přítomnou ve sporolu v dalším kroku syntézy.[25]
Oxidace heteroatomu
Funkční skupiny obsahující heteroatomy v nižších oxidačních číslech lze zoxidovat kyselinou trifluorperoctovou.[5] Často se takto oxiduje jod (příkladem je výše uvedená příprava sloučeniny s hypervalentním jodem z jodbenzenu), dusík, síra nebo selen.
U dusíkatých sloučenin lze uvést oxidaci oximů[5] a primárních aromatických aminů[15] na příslušné nitrosloučeniny[7] (i za přítomnosti substituentů snižujících elektronovou hustotu); například pentafluoranilin se oxiduje na pentafluornitrobenzen,[26] nitrosaminy na nitraminy,[7][14] dají se takto připravit aromatické N-oxidy a azin-N-oxidy,[5][27] a nitrososloučeniny lze tímto způsobem zoxidovat na nitrosloučeniny či nitraminy.[5]
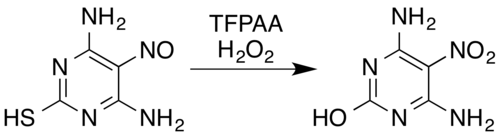
Například nitrososubstituovaný derivát pyrimidinu 4,6-diamino-5-nitrosopyrimidin-2-thiol se oxiduje na nitrosloučeninu směsí peroxidu vodíku a kyseliny trifluorperoctové, přičemž se rovněž odštěpuje thiolová skupina oxidačně hydrolytickou desulfurací.[5][28]
Sulfidové skupiny (R1SR2) lze kyselinou trifluorperoctovou oxidovat, v závislosti na reakčních podmínkách, na sulfoxidy (R1–S(O)–R2) a/nebo sulfony (R1–S(O)2–R2).[5] Selenoethery (R1–Se–R2) se podobně oxidují na selenony (R1–Se(O)2–R2), zde ovšem nedochází k tvorbě selenoxidů, tedy analogů sulfoxidů, v izolovatelné podobě,[3] tato reakce je obzvláště účinná, pokud je R1 a/nebo R2 arylová skupina.
Sulfinylchloridy (RS(O)Cl) se vyrábí reakcí odpovídajícího thiolu s chloridem sulfurylu SO2Cl2. Pokud místo toho vznikne sulfenylchlorid (RSCl), tak se přidá kyselina trifluorperoctová, jež umožní vznik požadovaného sulfinylchloridu. Na následujícím obrázku je zobrazena syntéza 2,2,2-trifluor-1,1-difenylethanthiolu:[29]
Cl.png.webp)
U oxidace thiofenu kyselinou trifluorperoctovou dochází k „soutěžení“ různých reakčních mechanismů a může tak vzniknout produkt S oxidace i epoxidace.[30][31][32][33] Hlavním mechanismem vzniká sulfoxid, který ovšem podstupuje dimerizaci Dielsova–Alderova typu předtím než může dojít k oxidaci; mezi produkty reakce nebyly nalezeny thiofen-S-oxid ani thiofen-S,S-dioxid.[5][30] Dimer lze následně dále oxidovat a převést tak jednu z S-oxidových skupin na S,S-dioxid. Ve vedlejším mechanismu dochází k Priležajevově epoxidaci,[23] jejímž produktem je thiofen-2-on.[30] Bylo prokázáno, že epoxidace zde není vedlejší reakcí S-oxidového meziproduktu[34] a pomocí izotopového značkování bylo zjičtěno, že dochází k 1,2-hydridovému posunu a uvolňuje se katontový meziprodukt.[30] Použití kyseliny trifluorperoctové je při této reakci výhodné, protože přítomná voda omezuje průběh vedlejšího reakčního mechanismu.[30]
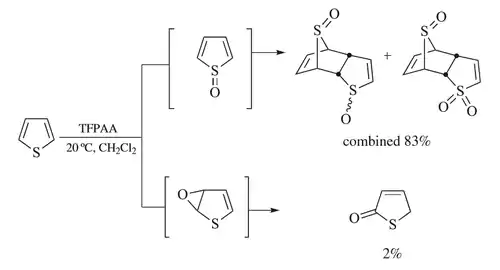
Oxidace se zásaditým přesmykem
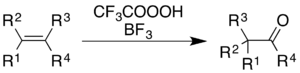
Pomocí směsi kyseliny trifluorperoctové a fluoridu boritého (sloužícího jako katalyzátor) lze oxidovat alkeny a areny za současného molekulového přesmyku na „kostře“ molekuly.[5]
U alkenů dochází k epoxidaci následované Wagnerovým–Meerweinovým přesmykem katalyzovaným BF3:[35]
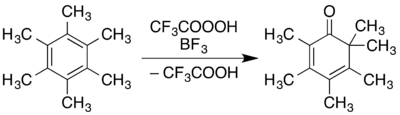
Podobná oxidace aromatické sloučeniny, konkrétně oxidace 1,2,3,4,5,6-hexamethylbenzenu na 2,3,4,5,6,6-hexamethyl-2,4-cyklohexadienon, je znázorněna na následujícím obrázku:
Oxidační štěpení arenů
Kromě samotné oxidace aromatických sloučenin na sloučeniny karbonylové může být kyselina trifluorperoctová použita rovněž ke štěpení vazeb mezi uhlíkovými atomy v aromatickém kruhu. Na rozdíl od jiných oxidací alkylaromatických látek, při nichž štěpením alkylového řetězce na benzylu vzniká kyselina benzoová nebo podobné látky, zde dochází k „obrácené oxodaci“, přičemž se štěpí samotné aromatické jádro.[36][37]
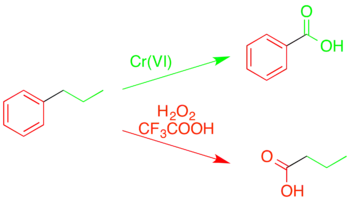
Tato selektivita u některých typů vazeb umožňuje rozklad složitých směsí uhlovodíků, jako je například uhlí, za účelem zjištění jejich struktury.[38][36]
U heterocyklických aromatických sloučenin k tomuto druhu štěpení nedochází kvůli přednostní oxidaci heteroatomů a deaktivaci aromatického kruhu vůči elektrofilním reakcím s peroxykyselinami; například pyridiny, puriny a chinoliny místo toho vytvářejí N-oxidy,[5] zatímco sirné heterocykly jako oktafluordibenzothiofen se přeměňují na sulfony.[7][39]
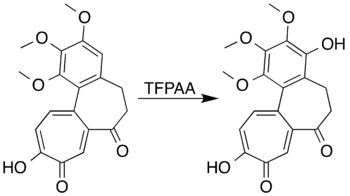
Aromatické sloučeniny obsahující aktivující substituenty mohou být zoxidovány na fenoly a otevírání aromatického kruhu u nich nenastává, například mesitylen reaguje s kyselinou trifluorperoctovou za vzniku mesitolu (2,4,6-trimethylfenolu).[7] Při pokusech o přípravu laktonu Baeyerovou–Villigerovou oxidací 7-oxodeacetamidokolchicinu se nepodařilo získat požadovaný produkt, ovšem došlo k oxidaci aromatického kruhu za vzniku fenolové sloučeniny, a to s vysokou výtěžností.[5][40]
Reference
V tomto článku byl použit překlad textu z článku Trifluoroperacetic acid na anglické Wikipedii.
- KÜRTI, László; CZAKÓ, Barbara. Strategic Applications of Named Reactions in Organic Synthesis. [s.l.]: Elsevier Academic Press, 2005. ISBN 9780124297852. S. 28. (anglicky)
- HIYAMA, Tamejiro. Organofluorine Compounds: Chemistry and Applications. [s.l.]: Springer Science & Business Media, 2000. Dostupné online. ISBN 9783662041642. Kapitola 8.2 Trifluoroacetic acid and Trifluoroperacetic acid, s. 255–257. (anglicky)
- KATAOKA, T.; YOSHIMATSU, M. Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Redakce Ley Steven V.. [s.l.]: Elsevier, 1995. (Comprehensive Organic Functional Group Transformations). Dostupné online. ISBN 9780080423234. Kapitola Alkyl Chalcogenides: Selenium- and Tellurium-based Functional Groups, s. 277–296. (anglicky)
- CAREY, Francis A.; SUNDBERG, Richard J. Advanced Organic Chemistry: Part A: Structure and Mechanisms. 5th. vyd. [s.l.]: Springer Science & Business Media, 2007. Dostupné online. ISBN 9780387448978. Kapitola 5.5 Addition Reactions Involving Epoxides, s. 503–514. (anglicky)
- CASTER, Kenneth C.; RAO, A. Somasekar; MOHAN, H. Rama; MCGRATH, Nicholas A.; BRICHACEK, Matthew. e-EROS Encyclopedia of Reagents for Organic Synthesis. Trifluoroperacetic Acid. [s.l.]: [s.n.], 2012. DOI 10.1002/047084289X.rt254.pub2. (anglicky)
- FREEMAN, Jeremiah P. William D. Emmons: November 18, 1924 – December 8, 2001. Organic Syntheses. November 14, 2002, s. xxvii–xxix. Dostupné online. (anglicky) Archivovaná kopie. www.orgsyn.org [online]. [cit. 2018-12-13]. Dostupné v archivu pořízeném z originálu dne 2015-03-16.
- CHAMBERS, Richard D. Fluorine in Organic Chemistry. [s.l.]: CRC Press, 2004. Dostupné online. ISBN 9780849317903. Kapitola Functional Compounds Containing Oxygen, Sulphur or Nitrogen and their Derivatives, s. 242–243. (anglicky)
- LUXON, S. G. Hazards in the Chemical Laboratory. 5th. vyd. [s.l.]: Royal Society of Chemistry, 1992. ISBN 9780851862293. S. 627. (anglicky)
- HART, Harold; LANGE, Richard M.; COLLINS, Peter M. 2,3,4,5,6,6-Hexamethyl-2,4-cyclohexadien-1-one. Org. Synth.. 1968, s. 87. Dostupné online. DOI 10.15227/orgsyn.048.0087. (anglicky); Coll. Vol.. S. 598. (anglicky)
- COOPER, Mark S.; HEANEY, Harry; NEWBOLD, Amanda J.; SANDERSON, William R. Oxidation Reactions Using Urea–Hydrogen Peroxide; A Safe Alternative to Anhydrous Hydrogen Peroxide. Synlett. 1990, s. 533–535. DOI 10.1055/s-1990-21156. (anglicky)
- ZIEGLER, Fredrick E.; METCALF, Chester A.; NANGIA, Ashwini; SCHULTE, Gayle. Structure and total synthesis of sporol and neosporol. Journal of the American Chemical Society. 1993, s. 2581–2589. DOI 10.1021/ja00060a006. (anglicky)
- KANG, Ho-Jung; JEONG, Hee-Sun. New Method of Generating Trifluoroperoxyacetic acid for the Baeyer-Villiger Reaction. Bull. Korean Chem. Soc.. 1996, s. 5–6. Dostupné online. (anglicky)
- EMMONS, William D.; FERRIS, Arthur F. Oxidation Reactions with Pertrifluoroacetic Acid. Journal of the American Chemical Society. 1953, s. 4623–4624. DOI 10.1021/ja01114a539. (anglicky)
- EMMONS, William D. Peroxytrifluoroacetic Acid. I. The Oxidation of Nitrosamines to Nitramines. Journal of the American Chemical Society. 1954, s. 3468–3470. DOI 10.1021/ja01642a029. (anglicky)
- EMMONS, William D. Peroxytrifluoroacetic Acid. II. The Oxidation of Anilines to Nitrobenzenes. Journal of the American Chemical Society. 1954, s. 3470–3472. DOI 10.1021/ja01642a030. (anglicky)
- EMMONS, William D.; PAGANO, Angelo S.; FREEMAN, Jeremiah P. Peroxytrifluoroacetic Acid. III. The Hydroxylation of Olefins. Journal of the American Chemical Society. 1954, s. 3472–3474. DOI 10.1021/ja01642a031. (anglicky)
EMMONS, William D.; PAGANO, Angelo S. Peroxytrifluoroacetic Acid. IV. The Epoxidation of Olefins. Journal of the American Chemical Society. 1955, s. 89–92. DOI 10.1021/ja01606a029. (anglicky)
EMMONS, William D.; LUCAS, George B. Peroxytrifluoroacetic Acid. V. The Oxidation of Ketones to Esters. Journal of the American Chemical Society. 1955, s. 2287–2288. DOI 10.1021/ja01613a077. (anglicky)
EMMONS, William D.; PAGANO, Angelo S. Peroxytrifluoroacetic Acid. VI. The Oxidation of Oximes to Nitroparaffins. Journal of the American Chemical Society. 1955, s. 4557–4559. DOI 10.1021/ja01622a036. (anglicky) - AUBÉ, Jeffrey; FEHL, Charlie; LIU, Ruzhang; MCLEOD, Michael C.; MOTIWALA, Hashim F. Heteroatom Manipulations. [s.l.]: [s.n.], 1993. (Comprehensive Organic Synthesis II; sv. 6). DOI 10.1016/B978-0-08-097742-3.00623-6. Kapitola 6.15 Hofmann, Curtius, Schmidt, Lossen, and Related Reactions, s. 598–635. (anglicky)
- ALMOND, M. R.; STIMMEL, J. B.; THOMPSON, E. A.; LOUDON, G. M. Hofmann Rearrangement Under Mildly Acidic Conditions Using [I,I-Bis(Trifluoroacetoxy)]Iodobenzene: Cyclobutylamine Hydrochloride from Cyclobutanecarboxamide. Org. Synth.. 1988, s. 132. Dostupné online. DOI 10.15227/orgsyn.066.0132. (anglicky); Coll. Vol.. S. 132. (anglicky)
- MYERS, Andrew G. Chemistry 115 Handouts: Oxidation [online]. Harvard University [cit. 2017-01-10]. Dostupné online. (anglicky)
- CARRUTHERS, William. Some Modern Methods of Organic Synthesis. [s.l.]: Cambridge University Press, 1971. Dostupné online. ISBN 9780521096430. Kapitola 6.3 Oxidation of Olefins, s. 259–280. (anglicky)
- CARRUTHERS, William. Some Modern Methods of Organic Synthesis. [s.l.]: Cambridge University Press, 1971. Dostupné online. ISBN 9780521096430. Kapitola 6.5 Baeyer–Villiger oxidation of ketones, s. 287–290. (anglicky)
- PRILESCHAJEW, Nikolaus. Oxydation ungesättigter Verbindungen mittels organischer Superoxyde. Chemische Berichte. 1909, s. 4811–4815. DOI 10.1002/cber.190904204100. (German)
- HAGEN, Timothy J. Name Reactions of Functional Group Transformations. Redakce Li Jie Jack. [s.l.]: John Wiley & Sons, 2007. Dostupné online. ISBN 9780470176504. Kapitola Prilezhaev reaction, s. 274–281. (anglicky)
- HAYAKAWA, Y.; BABA, Y.; MAKINO, S.; NOYORI, R. Carbon-carbon bond formation promoted by transition metal carbonyls. 19. General synthesis of tropane alkaloids via the polybromo ketone-iron carbonyl reaction. Journal of the American Chemical Society. 1978, s. 1786–1791. DOI 10.1021/ja00474a021. (anglicky)
- Part B: Bicyclic and Tricyclic Sesquiterpenes. Redakce Pirrung Michael C.. [s.l.]: John Wiley & Sons, 2000. (The Total Synthesis of Natural Products; sv. 11). Dostupné online. ISBN 9780470129630. Kapitola 10. Neosporol, Sporol, s. 222–224. (anglicky)
- BROOKE, G. M.; BURDON, J.; TATLOW, J. C. Aromatic polyfluoro-compounds. Part VII. The reaction of pentafluoronitrobenzene with ammonia. Journal of the Chemical Society. 1961, s. 802–807. DOI 10.1039/JR9610000802. (anglicky)
- WILLIAMS, W. Michael; DOLBIER, William R. Thermal and photochemical rearrangements of azine oxides. I. Pyrolytic decomposition to nitriles. Journal of Organic Chemistry. 1969, s. 155–157. DOI 10.1021/jo00838a034. (anglicky)
- TAYLOR, Edward C.; MCKILLOP, Alexander. A New Synthesis of 5-Nitropyrimidines. Journal of Organic Chemistry. 1965, s. 3153–3155. DOI 10.1021/jo01020a067. (anglicky)
- PAGE, P. C. B.; WILKES, R. D.; REYNOLDS, D. Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Redakce Ley Steven V.. [s.l.]: Elsevier, 1995. (Comprehensive Organic Functional Group Transformations). Dostupné online. ISBN 9780080423234. Kapitola Alkyl Chalcogenides: Sulfur-based Functional Groups, s. 113–276. (anglicky)
- TREIBER, Alexander. Mechanism of the Aromatic Hydroxylation of Thiophene by Acid-Catalyzed Peracid Oxidation. Journal of Organic Chemistry. 2002, s. 7261–7266. DOI 10.1021/jo0202177. (anglicky)
- MANSUY, Daniel; VALADON, Philippe; ERDELMEIER, Irene; LÓPEZ GARCIA, Pilar; AMAR, Claudine; GIRAULT, Jean-Pierre; DANSETTE, Patrick M. Thiophene S-Oxides as new Reactive Metabolites: Formation by Cytochrome P-450 Dependent Oxidation and Reaction with Nucleophiles. J. Am. Chem. Soc.. 1991, s. 7825–7826. DOI 10.1021/ja00020a089. (anglicky)
- CORREIA, Maria A.; HOLLENBERG, Paul F. Cytochrome P450: Structure, Mechanism, and Biochemistry. Redakce Ortiz de Montellano Paul R.. 4th. vyd. [s.l.]: Springer Publishing, 2015. Dostupné online. ISBN 9783319121086. Kapitola Inhibition of Cytochrome P450 Enzymes, s. 177–260. (anglicky)
- MACHEREY, Anne-Christine; DANSETTE, Patrick M. The Practice of Medicinal Chemistry. Redakce Wermuth Camille Georges. 4th. vyd. [s.l.]: Elsevier, 2015. Dostupné online. ISBN 9780124172135. Kapitola Biotransformations Leading to Toxic Metabolites:Chemical Aspects, s. 585–614. (anglicky)
- ANSLYN, Eric V.; DOUGHERTY, Dennis A. Modern Physical Organic Chemistry. [s.l.]: University Science Books, 2006. Dostupné online. ISBN 9781891389313. Kapitola 8.8 Miscellaneous Experiments for Studying Mechanism, s. 471–482. (anglicky)
- HART, Harold; LERNER, Lawrence R. Oxidations with peroxytrifluoroacetic acid-boron trifluoride. IX. Direct oxidation of alkenes to ketones using peroxytrifluoroacetic acid–boron fluoride. Journal of Organic Chemistry. 1967, s. 2669–2673. DOI 10.1021/jo01284a004. (anglicky)
- DENO, Norman C.; GREIGGER, Barbara A.; STROUD, Stephen G. New method for elucidating the structures of coal. Fuel. 1978, s. 455–459. DOI 10.1016/0016-2361(78)90153-9. (anglicky)
- DENO, Norman C.; GREIGGER, Barbara A.; MESSER, Lauren A.; MEYER, Michael D.; STROUD, Stephen G. Aromatic ring oxidation of alkylbenzenes. Tetrahedron Letters. 1977, s. 1703–1704. DOI 10.1016/S0040-4039(01)93253-8. (anglicky)
- DENO, Norman C.; CURRY, Kenneth W.; GREIGGER, Barbara A.; JONES, A. Daniel; RAKITSKY, Walter G.; SMITH, Karen A.; WAGNER, Karen. Dihydroaromatic structure of Illinois No. 6 Monterey coal. Fuel. 1980, s. 694–698. Dostupné online. DOI 10.1016/0016-2361(80)90021-6. (anglicky)
- CHAMBERS, R. D.; CUNNINGHAM, J. A.; SPRING, D. J. Polyfluoroaryl organometallic compounds. Part VIII. Synthesis of and nucleophilic substitution in octafluorodibenzofuran. Journal of the Chemical Society C. 1968, s. 1560–1565. DOI 10.1039/J39680001560. (anglicky)
- BERG, Ulf; BLADHA, Håkan; MPAMPOSA, Konstantinos. Stereochemical variations on the colchicine motif. Peracid oxidation of thiocolchicone. Synthesis, conformation and inhibition of microtubule assembly. Organic and Biomolecular Chemistry. 2004, s. 2125–2130. (anglicky)