Anilin
Anilin, systematicky benzenamin nebo fenylamin, je bezbarvá olejovitá kapalina. Na vzduchu snadno oxiduje a barví se na žlutou až hnědou barvu. Je toxický, má zásaditou reakci. Také je to v největším množství vyráběná organická zásada.
| Anilin | |
|---|---|
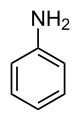
Strukturní vzorec anilinu | |
Prostorový model | |
| Obecné | |
| Systematický název | aminobenzen, benzenamin, fenylamin |
| Triviální název | anilin |
| Funkční vzorec | C6H5NH2 |
| Sumární vzorec | C6H7N |
| Vzhled | bezbarvá (na světle žloutnoucí) kapalina s charakteristickým zápachem |
| Identifikace | |
| Registrační číslo CAS | 62-53-3 |
| EC-no (EINECS/ELINCS/NLP) | 200-539-3 |
| Indexové číslo | 612-008-00-7 |
| Vlastnosti | |
| Molární hmotnost | 93,13 g/mol |
| Teplota tání | −6,3 °C |
| Teplota varu | 184,13 °C |
| Hustota | 1,027 g/cm³ |
| Viskozita | 4,4 mPa•s (20 °C) |
| Disociační konstanta pKb | 9,37 |
| Rozpustnost ve vodě | 36 g/l (20 °C) |
| Struktura | |
| Dipólový moment | 1,55 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H351 H341 H331 H311 H301 H372 H318 H317 H400 |
| R-věty | R23/24/25 R40 R41 R43 R48/23/24/25 R68 R50 |
| S-věty | S1/2 S26 S27 S36/37/39 S45 S46 S61 S63 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Používaný název aminobenzen není systematický (lze ho pokládat za polotriviální), neboť přítomnost aminové skupiny se v uhlovodíkovém řetězci vyjadřuje primárně příponou -amin.[2]
V přírodě se anilin nachází v černouhelném dehtu, průmyslově se vyrábí redukcí nitrobenzenu. Používá se při výrobě barviv, léčiv, plastů a gumárenských chemikálií (pomáhá urychlovat přeměnu kaučuku na pryž, tzv. vulkanizaci).[3] V současnosti má tato látka největší využití jako reakční komponenta při výrobě polyuretanů.
Příprava
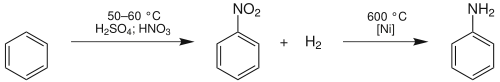
Průmyslově se anilin vyrábí většinou z benzenu, a to ve dvou krocích. Prvním krokem je nitrace benzenu pomocí nitrační směsi kyseliny dusičné a kyseliny sírové. Vzniklý nitrobenzen se poté hydrogenuje při teplotě 600 °C za použití katalyzátoru niklu.
Další používanou technologií je proces vyvinutý v České republice prof. Paškem z VŠCHT Praha. Jeho podstatou je hydrogenace nitrobenzenu na anilin na měděném katalyzátoru při teplotě 215 °C. Tímto procesem se v současnosti vyrábí asi 10 % světové výroby anilinu[zdroj?] a je realizován v BCH MCHZ Ostrava a licenčně v Japonsku. Další jednotky jsou projektovány mj. v Rusku.[zdroj?]
V laboratoři se používá redukce nitrobenzenu v prostředí kyseliny chlorovodíkové s železem.
Toxicita
K otravě dochází požitím, nadýcháním nebo vstřebáním kůži. Projevuje se cyanózou (modrofialové zbarvení kůže a sliznic způsobené nedostatečným okysličováním krve). Anilin je krevní jed a způsobuje oxidaci krevního barviva hemoglobinu na methemoglobin. Působí také na centrální nervový systém, proto postižený jeví podobné známky jako opilec. Zmodrání kůže se projevuje v první řadě na rtech, uších, nosu a nehtech. Dalším symptomem je bolest hlavy. Smrtelná dávka je 1 g, snižuje se však účinkem ethanolu.[zdroj?]
Po požití jako první pomoc podáme 100–200 ml parafinového oleje (ne však jiného oleje či tuku!) a vyvoláme zvracení. Doporučená je konzumace černé kávy.[zdroj?] Nesmí se podávat mléko, alkohol či tuky. Postiženého uložíme na čerstvý vzduch a zařídíme převoz k nemocničnímu ošetření.
Chemické reakce
Aromatická elektrofilní substituce
Dusík v aminové skupině má volný elektronový pár, který jednak způsobuje zásadité vlastnosti (dle Lewisovy teorie kyselin a zásad) a jednak aktivuje benzenové jádro pro elektrofilní substituce. Substituční reakce dokonce probíhá tak rychle, že je obtížné ji zastavit v prvním kroku[zdroj?] a vznikají trisubstituované deriváty. Obsazují polohy ortho a para vzhledem k aminoskupině. Možností, jak připravit monosubstituovaný derivát, je oslabit účinek aminoskupiny acetylací za vzniku acetanilidu a v dalším kroku provést substituci.
Diazotace a kopulace
Diazotace a kopulace jsou základní reakce pro přípravu barevných látek, jako například Sudan III, který má ohnivě červenou barvu. Tato barviva se obecně nazývají azosloučeniny, protože obsahují azo skupinu : -N=N-.
- Nejprve se reakcí anilinu s dusitanem v prostředí zředěné kyseliny chlorovodíkové připraví benzendiazoniová sůl. To je poměrně stálá pevná látka iontového charakteru. Na obou dusících je delokalizovaný kladný náboj a chlor je zde ve formě chloridu.
- V druhém kroku dochází ke kopulaci benzendiazoniové soli s nukleofilním činidlem, které má přebytek elektronů. Vzniká azosloučenina. Pokud je nukleofilním činidlem aromát – například fenol nebo arylamin –, pak je ve výsledné molekule konjugovaný systém dvojných a jednoduchých vazeb, který je zachycuje kvanta světelného záření a látka se jeví jako barevná.
Kontaminace nylonového nádobí
Spolu s dalšími primárními aminy se může uvolňovat z nylonového nádobí. Pravděpodobně proto, že k jeho barvení užívají azobarviva a primární aminy se uvolňují v důsledku působení vysokých teplot při styku nádobí s horkými potravinami.[4]
Reference
- Aniline. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- KOTVALTOVÁ SEZEMSKÁ, KAROLÍNA, 1990-. Názvosloví organických sloučenin. Vydání 2., upravené. vyd. Praha: [s.n.] 239 s. Dostupné online. ISBN 978-80-200-3075-7, ISBN 80-200-3075-1. OCLC 1143810036
- Otec českých organických technologií | Technický týdeník. www.technickytydenik.cz [online]. [cit. 2019-10-13]. Dostupné online.
- Co se může uvolňovat z černého plastového nádobí? Okem nic nepoznáte
Literatura
- Svoboda, Jiří: Organická chemie I, Vysoká škola chemicko-technologická, Praha 2005




