Peroxidová kyselina
Peroxidová kyselina (obvykle označovaná jednoslovně peroxykyselina, peroxokyselina nebo perkyselina) je kyselina, u níž je skupina -OH nahrazena skupinou -OOH. Tyto kyseliny se tvoří především prvky ze čtrnácté, patnácté a šestnácté skupiny periodické tabulky, ovšem triely a určité přechodné kovy mohou též tvořit peroxidové kyseliny. Nejširší škálu peroxidových kyselin tvoří síra a fosfor, včetně některých kondenzovaných forem, jako je kyselina perdifosforečná (H4P2O8) a kyselina perdisiřičitá (H2S2O8).
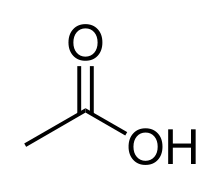
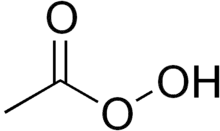
Protože obecně patří mezi velmi silná oxidační činidla, většina peroxidových kyselin se připravuje elektrolytickou oxidací běžných kyslíkatých kyselin. Typicky se k dosažení dobré výtěžnosti musí použít vysoká proudová hustota - nejvýznamnějším příkladem je elektrolýza kyseliny sírové. Peroxidové kyseliny obecně nejsou příliš stabilní v roztocích a rozkládají se na běžnou kyselinu a kyslík, ovšem výrazně stabilnější bezvodé formy lze vytvořit reakcí peroxidu vodíku s kyselinou chlorsírovou nebo chlorid-oxidem fosforečným.
Všechny peroxidové kyseliny jsou velmi silnými oxidačními činidly. Některé patří mezi peroxykarboxylové kyseliny, například kyselina meta-chlorperbenzoová (mCPBA), používané jako reagencia v Baeyer-Villigerově oxidaci a v oxidaci dvojných vazeb uhlík-uhlík v alkenech, kdy vznikají epoxidy (oxirany). Peruhličitan sodný (Na2CO4) se široce používá jako domácí bělidlo textilií, zatímco perdisiřičitany sodný, draselný a amonný (Na2S2O8, K2S2O8 a (NH4)2S2O8) jsou běžně používanými oxidačními činidly v laboratořích.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Peroxidová kyselina na Wikimedia Commons
Obrázky, zvuky či videa k tématu Peroxidová kyselina na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Peroxy acid na anglické Wikipedii.