Dioxolan
1,3-dioxolan (často nazývaný pouze dioxolan) je heterocyklická sloučenina a cyklický acetal se vzorcem (CH2)2O2CH2; jeho izomer 1,2-dioxolan je cyklický organický peroxid. Podobá se tetrahydrofuranu, který má místo jednoho kyslíku methylenovou (CH2) skupinu. Obdobný šestičlenný heterocyklus se nazývá dioxan. 1,3-dioxolan se používá jako rozpouštědlo a jako komonomer při přípravě polyacetalů.
| 1,3-dioxolan | |
|---|---|
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | 1,3-dioxolan |
| Sumární vzorec | C3H6O2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 646-06-0 |
| EC-no (EINECS/ELINCS/NLP) | 211-463-5 |
| PubChem | 12586 |
| ChEBI | 87597 |
| SMILES | O1CCOC1 |
| InChI | 1S/C3H6O2/c1-2-4-5-3-1/h1-3H2 |
| Vlastnosti | |
| Molární hmotnost | 74,079 g/mol |
| Teplota tání | −95 °C (178 K)[1] |
| Teplota varu | 78 °C (351 K)[1] |
| Hustota | 1,06 g/cm3 (20 °C)[1] |
| Index lomu | 1,3974 (20 °C)[1] |
| Rozpustnost ve vodě | rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v acetonu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v diethyletheru[1] |
| Tlak páry | 10,5 kPa (20 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225}[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P280 P303+361+353 P370+378 P403+235 P501[1] |
| Teplota vzplanutí | 2 °C (275 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Skupina sloučenin
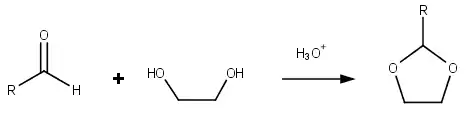
Jako dioxolany se nazývají i další sloučeniny obsahující dioxolanové kruhy. Dioxolany se dají připravit reakcemi aldehydů a ketonů s ethylenglykolem.[2]
L-(+)-cis-2-Methyl-4-trimethylamoniummethyl-1,3-dioxolanjodid, triviálně nazývaný (+)-cis-dioxolan, funguje jako agonista muskarinového acetylcholinového receptoru.
Dioxolanové chránicí skupiny
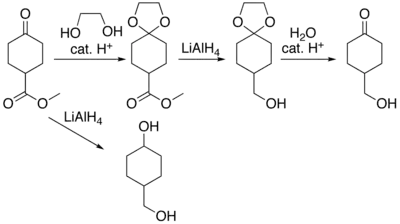
Organické sloučeniny obsahující karbonylové skupiny musejí být někdy chráněny, aby nevstupovaly do nežádoucích reakcí, když mají být prováděny reakce na jiných skupinách. K navázání a odštěpení chránicích skupin na karbonylové sloučeniny existuje velké množství postupů,[3] k nímž patří i využití dioxolanů.[4] Jako příklad lze uvést sloučeninu methylcyklohexanon-4-karboxylát, u kterého redukcí hydridem lithno-hlinitým vzniká 4-hydroxymethylcyklohexanol. Esterovou funkční skupinu lze zredukovat bez ovlivnění ketonové tím, že se keton přemění na ketal kysele katalyzovanou reakcí s ethylenglykolem, čímž se zamezí redukční reakci, chránicí skupina se poté odstraní hydrolýzou za vzniku 4-hydroxymethylcyklohexanonu.
K odstranění acetalových a ketalových chránicích skupin z karbonylových sloučenin lze také použít NaBArF4.[3][4] U 2-fenyl-1,3-dioxolanu trvá přeměna na benzaldehyd ve vodném roztoku při 30 °C pět minut.[5]
- PhCH(OCH2)2 + H2O PhCHO + HOCH2CH2OH
Výskyt
Jednou z přírodních látek obsahujících 1,3-dioxolanové skupiny je neosporol, což je izomer sporolu.[6]
Byla popsána totální syntéza obou sloučenin; v každém z těchto případů se tvoří dioxolanový kruh reakcí s kyselinou trifluoroctovou, připravené karbamidperoxidovou metodou.[7][8]
Při tomto postupu se nepoužívá voda,[9] protože by způsobovala nežádoucí vedlejší reakce.[7]
- CF3COOCOCF3 + H2O2•CO(NH2)2 → CF3COOOH + CF3COOH + CO(NH2)2
U neosporolu se používá Priležajevova reakce[10] s kyselinou trifluorperoctovou na přeměnu vhodného allylalkoholového prekurzoru na epoxid, který následně podstupuje rozšiřování kruhu přes bližší karbonylovou skupinu za vzniku dioxolanového kruhu.[7][8]
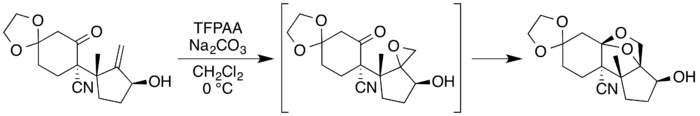
Podobný postup se využívá při totální syntéze sporolu, kdy se později dioxolanový kruh rozšiřuje na dioxanový.[6]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Dioxolane na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/12586
- R. A. DAIGNAULT, E. L. ELIEL. 2-Cyclohexyloxyethanol (involves acetalisation of cyclohexanone). Org. Synth.. 1973. Dostupné online. (anglicky); Coll. Vol.. S. 303. (anglicky)
- Theodora W. Greene; Peter G. M. Wuts. Greene's Protective Groups in Organic Synthesis [online]. Wiley-Interscience, 1999 [cit. 2017-06-20]. S. 297–304, 724–727. Dostupné v archivu pořízeném z originálu dne 2016-12-03. ISBN 9780471160199.
- Theodora W. Greene; Peter G. M. Wuts. Greene's Protective Groups in Organic Synthesis [online]. Wiley-Interscience, 1999 [cit. 2017-06-20]. S. 308–322, 724–727. Dostupné v archivu pořízeném z originálu dne 2016-12-07. ISBN 9780471160199.
- Chih-Ching Chang; Bei-Sih Liao; Shiuh-Tzung Liu. Deprotection of Acetals and Ketals in a Colloidal Suspension Generated by Sodium Tetrakis(3,5-trifluoromethylphenyl)borate in Water. Synlett. 2007, s. 283–287. DOI 10.1055/s-2007-968009.
- Part B: Bicyclic and Tricyclic Sesquiterpenes. [s.l.]: John Wiley & Sons, 2000. (The Total Synthesis of Natural Products; sv. 11). ISBN 9780470129630. Kapitola 10. Neosporol, Sporol, s. 222–224. (anglicky)
- Fredrick E. Ziegler; Chester A. Metcalf; Ashwini Nangia; Gayle Schulte. Structure and total synthesis of sporol and neosporol. Journal of the American Chemical Society. 1993, s. 2581–2589. DOI 10.1021/ja00060a006.
- Kenneth C. Caster; A. Somasekar Rao; H. Rama Mohan; Nicholas A. McGrath; Matthew Brichacek. e-EROS Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2012. ISBN 978-0471936237. DOI 10.1002/047084289X.rt254.pub2. Kapitola Trifluoroperacetic Acid, s. 283–287.
- Mark S. Cooper; Harry Heaney; Amanda J. Newbold; William R. Sanderson. Oxidation Reactions Using Urea–Hydrogen Peroxide; A Safe Alternative to Anhydrous Hydrogen Peroxide. Synlett. 1990, s. 533–535. DOI 10.1055/s-1990-21156.
- Timothy J. Hagen. Name Reactions of Functional Group Transformations. [s.l.]: John Wiley & Sons, 2007. ISBN 9780470176504. Kapitola Prilezhaev reaction, s. 274–281.
Související články
- Dioxan
