Jodbenzen
Jodbenzen je organická sloučenina se vzorcem C6H5I, její molekula je odvozena od benzenu náhradou jednoho vodíkového atomu atomem jodu. Používá se jako meziprodukt v organické syntéze. Obvykle jde o bezbarvou kapalinu, i když starší vzorky bývají nažloutlé.
| Jodbenzen | |
|---|---|
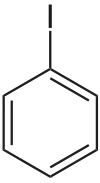
Strukturní vzorec | |

Model molekuly | |
| Obecné | |
| Systematický název | jodbenzen |
| Sumární vzorec | C6H5I |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 591-50-4 |
| EC-no (EINECS/ELINCS/NLP) | 209-719-6 |
| PubChem | 11575 |
| SMILES | C1=CC=C(C=C1)I |
| InChI | 1S/C6H5I/c7-6-4-2-1-3-5-6/h1-5H |
| Vlastnosti | |
| Molární hmotnost | 204,01 g/mol |
| Teplota tání | −31,3 °C (241,8 K)[1] |
| Teplota varu | 188,4 °C (461,6 K)[1] |
| Hustota | 1,808 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | 0,034 g/100 ml (30 °C)[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v acetonu, ethanolu a dimethylsulfoxidu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v benzenu, diethyletheru a tetrachlormethanu[1] |
| Tlak páry | 0,14 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H319 H332[1] |
| P-věty | P261 P264 P270 P271 P280 P301+312 P304+312 P304+340 P305+351+338 P312 P330 P337+313 P501[1] |
| Teplota vzplanutí | 77 °C (350 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
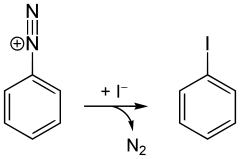
Jodbenzen může být zakoupen, lze jej však také připravit v laboratoři Sandmeyerovou reakcí z anilinu. V prvním kroku se provede diazotace aminové skupiny kyselinou chlorovodíkovou a dusitanem sodným za vzniku benzendiazoniumchloridu a plynného dusíku. Následně se přidá jodid draselný; produkt lze oddělit destilací s vodní parou.[2]
Další možnost představuje reakce jodu a kyseliny dusičné s benzenem.[3]
Reakce
Vazba C–I je slabší než vazby C–Br nebo C–Cl, jodbenzen je tak reaktivnější než brombenzen či chlorbenzen. Snadno reaguje s hořčíkem za tvorby Grignardova činidla, fenylmagnesiumjodidu. Fenylmagnesiumjodidje, podobně jako fenylmagnesiumbromid, syntetickým ekvivalentem fenylové skupiny. Reaguje s chlorem za vzniku komplexu, jodbenzendichloridu,[4] používaného jako pevný zdroj chloru.
Jodbenzen také může být substrátem Sonogaširových a Heckových reakcí, probíhajících přes oxidační adice jodbenzenu.
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Iodobenzene na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/11575
- H. J. LUCAS, E. R. KENNEDY. Iodobenzene. Org. Synth.. 1939. Dostupné online. (anglicky); Coll. Vol.. S. 351. (anglicky)
- F. B. DAINS AND R. Q. BREWSTER. Iodobenzene. Org. Synth.. 1941. Dostupné online. (anglicky); Coll. Vol.. S. 323. (anglicky)
- H. J. LUCAS AND E. R. KENNEDY. Iodobenzene dichloride. Org. Synth.. Dostupné online. (anglicky); Coll. Vol.. S. 482. (anglicky)