Chlorid sulfurylu
Chlorid sulfurylu (též sulfurylchlorid) (SO2Cl2) je sloučenina síry, kyslíku a chloru. Při pokojové teplotě je to bezbarvá kapalina štiplavého zápachu. Chlorid sulfurylu se nevyskytuje v přírodě, což lze dovodit i z toho, že podléhá rychlé hydrolýze.
| Chlorid sulfurylu | |
|---|---|
Struktura molekuly chloridu sulfurylu | |

Kapalná forma | |
| Obecné | |
| Systematický název | chlorid sulfurylu |
| Ostatní názvy | sulfurylchlorid dichlorid-dioxid sírový |
| Anglický název | Sulfuryl chloride |
| Německý název | Sulfurylchlorid |
| Sumární vzorec | SO2Cl2 |
| Vzhled | bezbarvá kapalina (postupem času žloutnoucí) |
| Identifikace | |
| Registrační číslo CAS | 7791-25-5 |
| EC-no (EINECS/ELINCS/NLP) | 232-245-6 |
| Indexové číslo | 016-016-00-6 |
| Vlastnosti | |
| Molární hmotnost | 134,971 g/mol |
| Teplota tání | −54,1 °C |
| Teplota varu | 69,1 °C |
| Teplota rozkladu | 160 °C |
| Hustota | 1,709 1 g/cm3 (0 °C) 1,66 g/cm3 (20 °C) 1,657 0 g/cm3 (25 °C) |
| Index lomu | nD= 1,443 7 |
| Rozpustnost ve vodě | reaguje |
| Rozpustnost v polárních rozpouštědlech |
aceton |
| Rozpustnost v nepolárních rozpouštědlech |
kapalné uhlovodíky chlorované uhlovodíky sirouhlík |
| Relativní permitivita εr | 9,15 (22 °C) |
| Tlak páry | 5,45 kPa (0 °C) 12,69 kPa (18 °C) 33,61 kPa (39 °C) 51,41 kPa (50 °C) |
| Měrná magnetická susceptibilita | −5,08×10−6 cm3g−1 |
| Struktura | |
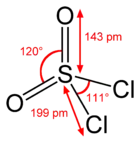
| Tvar molekuly | tetraedr |
| Dipólový moment | 6,0×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −389,8 kJ/mol |
| Entalpie varu ΔHv | 208 J/g |
| Standardní molární entropie S° | 216,3 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −305,0 kJ/mol |
| Izobarické měrné teplo cp | 0,973 5 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H314 H335 EUH014 |
| R-věty | R14 R34 R37 |
| S-věty | (S1/2) S26 S45 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Chlorid sulfurylu bývá často zaměňován s chloridem thionylu, SOCl2. Vlastnosti obou oxychloridů síry jsou však podstatně odlišné: chlorid sulfurylu je zdrojem chloru, kdežto chlorid thionylu je zdrojem chloridových iontů.
Struktura
Síra je v SO2Cl2 tetraedrická, váže se na dva atomy kyslíku dvojnými vazbami a na dva atomy chloru vazbami jednoduchými. Oxidační číslo síry je zde +6, podobně jako v H2SO4.
Syntéza
SO2Cl2 se připravuje reakcí oxidu siřičitého a chloru za přítomnosti katalyzátoru, například aktivního uhlí:
- SO2 + Cl2 → SO2Cl2
Surový produkt lze čistit frakční destilací. SO2Cl2 se obvykle nepřipravuje v laboratoři, protože je komerčně dostupný.
Reakce
Chlorid sulfurylu reaguje prudce s vodou, uvolňuje se při tom chlorovodík a zůstává kyselina sírová:
- 2 H2O + SO2Cl2 → 2 HCl + H2SO4
SO2Cl2 se také rozkládá při zahřátí na 100 °C a více, čili 30 °C nad jeho bod varu.
Postupem času se SO2Cl2 zvolna rozkládá na oxid siřičitý a chlor, což zbarvuje staré vzorky slabě nažloutle.
Použití
Chlorid sulfurylu se často používá jako zdroj Cl2. Protože jde o kapalinu, lze oproti plynnému Cl2 snadněji odměřovat, dávkovat a ukládat. SO2Cl2 se široce používá jako reagencium při konverzi sousedních C-H → C-Cl k aktivaci substituentů, např. karbonylů a sulfoxidů. Též se používá k chloraci alkanů, alkenů, alkynů, arenů a epoxidů. Takové reakce probíhají za přítomnosti volných radikálů, např. azobisisobutyronitrilu, jakožto iniciátorů. SO2Cl2 může též převádět alkoholy na alkylchloridy. Průmyslově se nejvíce chloridu sulfurylu využije při výrobě pesticidů.
SO2Cl2 lze použít také k ošetření vlny proti srážení.
Bezpečnost
SO2Cl2 je toxický, žíravý a působí jako lakrimátor. Jak je popsáno výše, může s vodou, stejně jako s donorovými rozpouštědly (např. dimethylsulfoxidem nebo dimethylformamidem), tvořit výbušné směsi.
Reference
V tomto článku byl použit překlad textu z článku Sulfuryl chloride na anglické Wikipedii.
- Sulfuryl chloride – SIDS Initial Assessment Report For SIAM 15
- Sulfuryl Chloride – Encyclopedia of Reagents for Organic Synthesis
- Sulfuryl chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- Lautens, M.; Bouchain, G. [4+3] Cycloaddition in Water. endo,endo-Dimethyl-8-Oxabicyclo[8-Oxabicyclo[3.2.1]oct-6-en-3-one. [s.l.]: [s.n.]
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid sulfurylu na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid sulfurylu na Wikimedia Commons

