Kyselina fenylboronová
Kyselina fenylboronová je organická sloučenina se vzorcem C6H5B(OH)2, patřící mezi boronové kyseliny, obsahující fenylovou a dvě hydroxylové skupiny navázané na atom boru. Jedná se o bílý prášek, často používaný v organické syntéze. Boronové kyseliny jsou mírně Lewisovsky kyselé a většinou stabilní, což je činí často používanými v organické syntéze.
| Kyselina fenylboronová | |
|---|---|
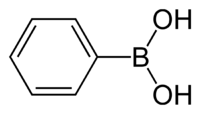
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | kyselina fenylboronová |
| Funkční vzorec | C6H5B(OH)2 |
| Sumární vzorec | C6H7BO2 |
| Vzhled | bílý až žlutý prášek |
| Identifikace | |
| Registrační číslo CAS | 98-80-6 |
| EC-no (EINECS/ELINCS/NLP) | 202-701-9 |
| PubChem | 66827 |
| ChEBI | 44923 |
| SMILES | B(c1ccccc1)(O)O |
| InChI | 1S/C6H7BO2/c8-7(9)6-4-2-1-3-5-6/h1-5,8-9H |
| Vlastnosti | |
| Molární hmotnost | 121,93 g/mol |
| Teplota tání | 219 °C (492 K)[1] |
| Disociační konstanta pKa | 8,83 |
| Rozpustnost ve vodě | 1 g/100 ml (20 °C) |
| Rozpustnost v polárních rozpouštědlech |
rozpustná v ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustná v diethyletheru[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H315 H319 H335[1] |
| P-věty | P261 P264 P270 P271 P280 P301+312 P302+352 P304+340 P305+351+338 P312 P321 P330 P332+313 P362 P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vlastnosti
Kyselina fenylboronová je rozpustná ve většině polárních organických rozpouštědel a špatně rozpustná v hexanu a tetrachlormethanu. Její molekula je rovinná, s C2V molekulovou symetrií. Atom boru je sp2 hybridizovaný a má prázdný p orbital. Krystaly této sloučeniny jsou ortorombické a prostřednictvím vodíkových vazeb vytvářejí shluky složené ze dvou molekul.[2]
Tyto dimerní jednotky jsou dále propojeny sítí vodíkových vazeb. Molekula je téměř rovinná, s odchylkami vazeb C-B 6,6° a 21.4° u dvou molekul PhB(OH)2.[3]
Příprava
Existuje několik postupů přípravy kyseliny fenylboronové. Jedním z nejčastějších je reakce fenylmagnesiumbromidu s trimethylboritanem za vzniku esteru PhB(OMe)2, jenž se následně hydrolyzuje.[4]
- PhMgBr + B(OMe)3 → PhB(OMe)2 + MeOMgBr
- PhB(OMe)2 + H2O → PhB(OH)2 + MeOH
Ostatní metody zahrnují použití elektrofilních borátů k zachycení fenylkovových meziproduktů ,vzniklých z fenylhalogenidů, a řízenou orthometalaci.[3] Fenylsilany a fenylstannany vstupují do transmetalačních reakcí s BBr3 a hydrolýzou jejich produktů se získává kyselina fenylboronová. Arylhalogenidy a aryltrifláty mohou reagovat s diboronylovými sloučeninami za katalýzy přechodnými kovy; ty mohou katalyzovat rovněž funkcionalizace aromatických vazeb C-H.
Reakce
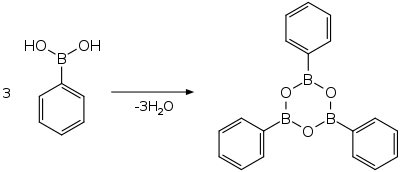
Dehydratací boronových kyselin vznikají příslušné trimerní anhydridy, nazývané boroxiny. Dehydratace jsou řízené tepelně, někdy se přidávají dehydratační činidla.[5]
Kyselina fenylboronová se účastní několika párovacích reakcí, kde slouží jako zdroj fenylových skupin; příkladem je Suzukiova reakce, kdy za přítomnosti katalyzátoru obsahujícího Pd0 a zásady reaguje s vinylhalogenidy, přičemž se tvoří fenylované alkeny.[6] Tato metoda byla zobecněna na přípravu biarylů reakcemi kyseliny fenylboronové s arylhalogenidy.
Při tvorbě vazeb C-C se často používá kyselina fenylboronová. alfa aminokyseliny mohou být získány nekatalyzovanými reakcemi alfa ketokyselin, aminů a kyseliny fenylboronové.[7]
Kyselina fenylboronová byla také využita při párovacích reakcích Heckova typu s alkeny a alkyny.[8]
Arylazidy a arylaromatické sloučeniny lze také připravit s použitím kyseliny fenylboronové.[3] Tuto kyselinu je rovněž možné regioselektivně halodeborovat pomocí vodných roztoků bromu, chloru nebo jodu:[9]
- PhB(OH)2 + Br2 + H2O → PhBr + B(OH)3 + HBr
Boronové estery se dají získat kondenzačními reakcemi boronových kyselin s alkoholy. Při těchto přeměnách se hydroxylové skupiny nahrazují alkoxy nebo aryloxy skupinami.[3] Reakce je vratná a posunu rovnováhy ve prospěch produktů pomocí Deanovy-Starkovy aparatury nebo přidáním dehydratačního činidla, které odstraní vznikající vodu.
- PhB(OH)2 + 2 ROH ⇌ PhB(OR)2 + 2 H2O
Rozšíření této reaktivity představuje použití PhB(OH)2 jako chránicí skupiny pro dioly a diaminy. Tohoto se využívá při aplikaci kyseliny fenylboronové jako čidla pro sacharidy, protimikrobiální látky, inhibitory enzymů, při léčbě nádorů záchytnou neutronovou terapií a v biokonjugaci a značkování bílkovin a povrchů buněk.[3]
Odkazy
Literatura
- Brown, H.C. Organic Synthesis via Boranses, Wiley, New York, 1975.
- Matteson, D. S. Stereodirected Synthesis with Organoboranes, Springer, Berlin, 1995. ISBN 978-3-540-59182-5
- Lappert, M. F. Organic Compounds Of Boron. Chem. Rev.. 1956, s. 959–1064. DOI 10.1021/cr50011a002. (anglicky)
- Pelter, A.; Smith, K.; Brown, H. C. Borane Reagents, Academic Press, New York, 1988.
- Mikhailov, B. M.; Bubnov, Y. N. Organoboron Compounds in Organic Synthesis, Harwood Academics, Glasgow, 1984. ISBN 3-7186-0113-3
Související články
- Kyselina 4-nonylfenylboronová
Reference
V tomto článku byl použit překlad textu z článku Phenylboronic acid na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/66827
- S. J. Rettig; J. Trotter. Crystal and molecular structure of phenylboronic acid, C6H5B(OH)2. Canadian Journal of Chemistry. 1977, s. 3071–3075. DOI 10.1139/v77-430.
- Hall, D. G. Boronic Acids; WILEY-VCH: Edmonton, Canada, 2005. ISBN 3-527-30991-8
- WASHBURN, RM; LEVENS, E; ALBRIGHT, CF; BILLIG, FA. Benzeneboronic anhydride. Org. Synth.. 1963. Dostupné online. (anglicky); Coll. Vol.. S. 68. (anglicky)
- H. R. Snyder; J. A. Snyder; J. R. Johnson. Organoboron Compounds, and the Study of Reaction Mechanisms. Primary Aliphatic Boronic Acids. Journal of the American Chemical Society. 1938, s. 105–111. DOI 10.1021/ja01268a033.
- N. Miyaura; A. Suzuki. Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst. Journal of the Chemical Society, Chemical Communications. 1979, s. 866. DOI 10.1039/C39790000866.
- N. A. Petasis; I. A. Xavialov. A New and Practical Synthesis of α-Amino Acids from Alkenyl Boronic Acids. Journal of the American Chemical Society. 1997, s. 445. DOI 10.1021/ja963178n.
- M. Sakai; H. Hayashi; N. Miyaura. Rhodium-Catalyzed Addition of Organoboronic Acids to Aldehydes. Angewandte Chemie International Edition. 1998, s. 3279. DOI 10.1002/(SICI)1521-3773(19981217)37:23<3279::AID-ANIE3279>3.0.CO;2-M. PMID 29711415.
- A. D. Ainley; F. Challenger. Studies of the boron–carbon linkage. Part I. The oxidation and nitration of phenylboric acid. Journal of the Chemical Society. 1930, s. 2171. DOI 10.1039/JR9300002171.
