Boroxin
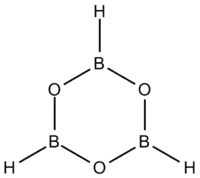
Boroxin je heterocyklická sloučenina s molekulami tvořenými šestičlennými cykly, ve kterých se střídají atomy kyslíku a boru spojené jednoduchými vazbami, přičemž na každý bor je navázán atom vodíku. Deriváty boroxinu, jako jsou trimethylboroxin a trifenylboroxin, se souhrnně označují jako boroxiny.[2] Jedná se o pevné látky, obvykle se za pokojové teploty vyskytující v rovnováze s příslušnými boronovými kyselinami.[2][3][4] Mimo teoretické studie se boroxin nejvíce využívá při výrobě optických zařízení.[5]
| Boroxin | |
|---|---|
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | 1,3,5,2,4,6-trioxatriborinan |
| Sumární vzorec | B3H3O3 |
| Identifikace | |
| Registrační číslo CAS | 289-56-5 |
| PubChem | 139461 |
| SMILES | O1BOBOB1 |
| InChI | 1S/B3H3O3/c1-4-2-6-3-5-1/h1-3H |
| Vlastnosti | |
| Molární hmotnost | 83,45 g/mol |
| Bezpečnost | |
| [1] | |
| H-věty | H360FD[1] |
| P-věty | P201 P202 P281 P308+313 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura
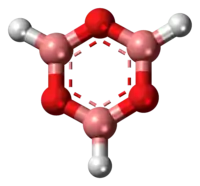
Trikoordinované sloučeniny boru mají obvykle trigonální rovinné geometrie a boroxinový kruh je tak rovněž rovinný.[3][6] Tyto sloučeniny jsou izoelektronické s benzenem. Díky prázdnému orbitalu p mohou mít částečně aromatické vlastnosti.[3][7]
Jednoduché vazby atomů boru v boroxinech jsou většinou typu s.[6] Ethylboroxin se vyznačuje vazebnými délkami 138,4 pm u vazby B-O a 156,5 pm u B-C.[7] V případě fenylboroxinu jsou délky odpovídajících vazeb 138,6 a 154,6 pm, což naznačuje jen malý vliv substituentu na velikost boroxinového kruhu.[7]
Substituenty boroxinu ovlivňují výslednou krystalovou strukturu. Nejjednodušší je u alkylovaných boroxinů, u nichž je vždy kyslíkový atom jedné molekuly spojen s atomem boru v druhé, takže každý atom boru se nachází mezi dvěma atomy kyslíku. Tímto se vytváří trubicovitá struktura. Mezimolekulové vzdálenosti B-O u ethylboroxinu činí 346,2 pm, což je výrazně více, než délka vazby B-O (138,4 pm). Krystalová struktura fenylboroxinu je složitější; interakce mezi prázdnými orbitaly p v atomech boru a π elektrony aromatických substituentů jsou příčinou odlišné struktury. Boroxinový kruh jedné molekuly je uzavřen mezi dva fenylové kruhy zbylých molekul. Toto uspořádání dovoluje fenylovým skupinám dodávat π elektronovou hustotu do prázdných p orbitalů boru.[7]
Příprava
Příprava boroxinů, objevená ve 30. letech 20. století, spočívá v dehydrataci příslušných boronových kyselin.[2][3][4] Dehydrataci je možné provést pomocí vysoušedla nebo zahříváním ve vysokém vakuu.[3] Trimethylboroxin lze též získat reakcí oxidu uhelnatého s diboranem (B2H6) za katalýzy borohydridem lithným (LiBH4):[6]
Reakce a použití
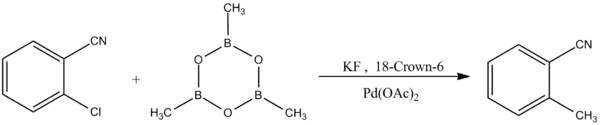
Trimethylboroxin se používá k methylacím arylhalogenidů skrz Suzukiovy reakce:[8]
Další druh Suzukiovy reakce vykazuje selektivitu vůči arylchloridům:[9]
Boroxiny také mohou sloužit jako prekurzory monomerních oxoboranů, HB≡O.[4] Tyto sloučeniny se rychle, i za nízkých teplot, přeměňují zpět na cyklické boroxiny.[4]
Reference
V tomto článku byl použit překlad textu z článku Boroxine na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/139461
- Brown, H.C. Boranes in Organic Chemistry; Cornell University Press: Ithaca, 1972; pp. 346–347.
- Hall, Dennis G. (2005). Boronic Acids – Preparation and Applications in Organic Synthesis and Medicine. John Wiley & Sons ISBN 3-527-30991-8
- Westcott, S. A. BO Chemistry Comes Full Circle. Angewandte Chemie International Edition. 2010, s. 9045–9046. DOI 10.1002/anie.201003379. PMID 20878818. (anglicky)
- Wu, Q.G.; G. WU; L. LEON BRANCA; S. WANG. B3O3Ph3 (7-Azaindole): Structure, Luminescence, and Fluxionality. Organometallics. 1999, s. 2552–2556. DOI 10.1021/om990053t. (anglicky)
- Onak, T. in Organoborane Chemistry; Maitles, P.M., Stone, F.G.A., West, R., Eds.; Academic Press: New York, 1975; pp. 2,4,16,44.
- M. C. Haberecht; Michael Bolte; Matthias Wagner; Hans-Wolfram Lerner. A New Polymorph of Tri(p-tolyl)boroxine. Journal of Chemical Crystallography. 2005, s. 657–665. DOI 10.1007/s10870-005-3325-y.
- M. Gray; I. P. Andrews; D. F. Hook; J. Kitteringham; M. Voyle. Practical Methylation of Aryl Halides by Suzuki-Miyaura Coupling. Tetrahedron. 2000, s. 6237–6240. DOI 10.1016/S0040-4039(00)01038-8.
- C. Song; Y. Ma; Q. Chai; C. Ma; W. Jaing; M. B. Andrus. Palladium Catalyzed Suzuki-Miyaura Coupling With Aryl Chlorides Using a Bulky Phenanthryl N-heterocyclic Carbene Ligand. Tetrahedron. 2005, s. 7438–7446. DOI 10.1016/j.tet.2005.05.071.