Trimethylboritan
Trimethylboritan je organická sloučenina se vzorcem B(OCH3)3. Tato látka je hořlavá a hoří zeleným plamenem kvůli přítomnosti boru. Trimethylboritan je mírně jedovatý, LD50 je asi 6 150 mg/kg.
| Trimethylboritan | |
|---|---|
Vzhled | |
Struktura | |
| Obecné | |
| Systematický název | Trimethylboritan |
| Ostatní názvy | TMB, trimethylester kyseliny borité |
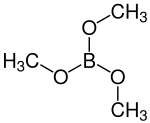
| Funkční vzorec | B(OCH3)3 |
| Sumární vzorec | BC3H9O3 |
| Vzhled | průhledná bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 121-43-7 |
| Vlastnosti | |
| Molární hmotnost | 103,91 g/mol |
| Teplota tání | −34°C; tj. 239 K |
| Teplota varu | 68–69 °C, 341–342 K |
| Hustota | 0,932 g/cm3 |
| Index lomu | 1,356 8 |
| Rozpustnost ve vodě | reaguje za vzniku kyseliny borité a methanolu |
| Rozpustnost v polárních rozpouštědlech |
methanol |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H226 H312 |
| R-věty | R10 R21 |
| S-věty | S2 S23 S25 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Tato látka se vyrábí reakcí kyseliny borité s methanolem podle rovnice:
B(OH)3 + 3CH3OH → B(OCH3)3 + 3H2O
Problém této reakce je, že je vratná. Aby se snížilo množství nezreagované kyseliny borité a methanolu, stačí snížit pH směsi, nejčastěji se k tomuto používá kyselina sírová. Tato směs se následně destiluje, aby se vytvořila čistá látka.
Popřípadě lze použít bromid boritý a methanol, pak ale místo vody vzniká bromovodík:
BBr3 + 3CH3OH → B(OCH3)3 + 3HBr
Reakce
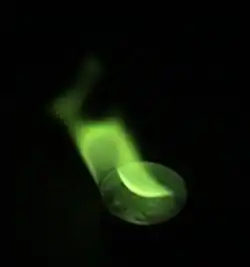
Tato látka reaguje se rozkládá při kontaktu s vodou za vzniku methanolu a kyseliny borité.
Při zapálení trimethylboritanu vzniká oxid uhličitý a voda:
2 B(OCH3)3 + 9 O2 → B2O3 + 6 CO2 + 9 H2O
Reference
- Trimethyl borate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Trimethylboritan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Trimethylboritan na Wikimedia Commons

