Ethyn
Ethyn (starší název ethin, triviální název acetylen) je nejjednodušší alkyn (uhlovodík s trojnou vazbou mezi uhlíky). Za normálního tlaku a teploty se jedná o bezbarvý plyn vonící po česneku. Jeho teplota varu je −80,8 °C.
| Acetylen | |
|---|---|
Strukturní vzorec | |

Prostorový model | |
| Obecné | |
| Systematický název | Ethyn |
| Triviální název | Acetylen |
| Sumární vzorec | C2H2 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 74-86-2 |
| Číslo EC (enzymy) | 200-816-9 |
| Číslo RTECS | 200-816-9 |
| Vlastnosti | |
| Molární hmotnost | 26,037 3 g/mol |
| Teplota tání | −84 °C |
| Teplota varu | −80,8 °C (1 013 hPa) |
| Hustota | 0,001 096 7 g/cm³ (plyn) |
| Kritická teplota Tk | 35,2 °C |
| Kritický tlak pk | 6 190 kPa |
| Rozpustnost ve vodě | 1 185 mg/l (20 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R5 R6 R12 |
| S-věty | (S2) S9 S16 S33 |
| NFPA 704 |  4
1
3
|
| Teplota vznícení | 305 °C |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |

Ethyn byl objeven v roce 1836 Edmundem Davym, který ho identifikoval jako „novou uhlíkatou sloučeninu vodíku“. Znovuobjeven byl v roce 1860 francouzským chemikem Marcellinem Berthelotem, který vymyslel název „acetylen“. Laureát Nobelovy ceny Nils Gustaf Dalén přišel o zrak v důsledku výbuchu acetylenu.
Příprava

z Gambie).
Hlavními surovinami pro výrobu acetylenu jsou uhličitan vápenatý (vápenec) a uhlí. Uhličitan vápenatý se nejdřív převede na oxid vápenatý a uhlí na koks, následně se tyto dvě látky nechávají spolu reagovat za vzniku acetylidu vápenatého a oxidu uhelnatého:
- CaO + 3C → CaC2 + CO
Acetylid vápenatý (též karbid) se pak nechává různými metodami reagovat s vodou, přičemž vzniká ethyn a hydroxid vápenatý. Tuto reakci objevil Friedrich Wöhler v roce 1862:
- CaC2 + 2H2O → Ca(OH)2 + C2H2
Syntéza acetylidu vápenatého vyžaduje extrémně vysoké teploty, okolo 2 000 °C, takže se reakce provádí v obloukové peci. Tato reakce byla důležitou součástí revoluce v chemii koncem 19. století, umožněné obrovským projektem výroby elektřiny ve vodní elektrárně na Niagarských vodopádech.
Ethyn lze vyrábět také částečným spalováním methanu s kyslíkem nebo krakováním uhlovodíků.
Berthelot dokázal připravit ethyn z methanolu, ethanolu, ethenu a etheru, když zaváděl tyto látky ve formě plynu či par do trubice rozžhavené do červena. Zjistil také, že ethyn vzniká při elektrickém jiskření ve směsi dikyanu a vodíku. Dokázal též vyrobit ethyn přímo slučováním čistého vodíku s uhlíkem pomocí elektrického výboje.
Reakce
- Pyrolýza začíná nad 400 °C (673 K), což je u uhlovodíku relativně nízko. Hlavními produkty jsou dimer vinylethyn (C4H4) a benzen. Při teplotách nad 900 °C (1 173 K) jsou hlavním produktem saze.
- Pomocí ethynu Berthelot jako první ukázal, že lze z alifatické sloučeniny udělat aromatickou, když zahříval ethyn ve skleněné trubici a získal benzen s určitým množstvím toluenu. Berthelot také oxidoval ethyn a získal tak kyseliny octovou a šťavelovou. Dále zjistil, že lze ethyn redukovat na ethen a ethan.
- Polymerací ethynu za přítomnosti Zieglerova–Nattova katalyzátoru lze vyrobit polyethynový (polyacetylenový) film. Polyethyn, řetězec uhlíkových molekul se střídáním jednoduchých a dvojných vazeb, byl prvním objeveným organickým polovodičem. Reakcí s jodem z něj lze získat extrémně vodivý materiál.
- V Kučerovově reakci (objevené v roce 1881 ruským chemikem Michailem Kučerovem)[2] je ethyn hydratován na acetaldehyd solí rtuti, například bromidem rtuťnatým. Před příchodem Wackerova procesu byla tato reakce používána v průmyslovém měřítku.[3]
Reppeho chemie
Walter Reppe objevil, že ethyn může za vysokých tlaků a přítomnosti katalyzátorů z těžkých kovů reagovat za vzniku průmyslově významných chemikálií:
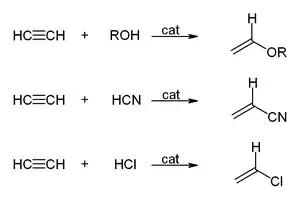
- Ethyn reagující s alkoholy, kyanovodíkem, chlorovodíkem nebo karboxylovými kyselinami dává vinylové sloučeniny:
- S aldehydy dává ethynylové dioly:
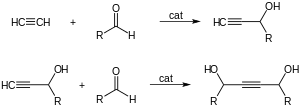
Toto se průmyslově používá k výrobě 1,4-butyndiolu z formaldehydu a ethynu:
- HCCH + CH2O → CH2(OH)CCCH2OH
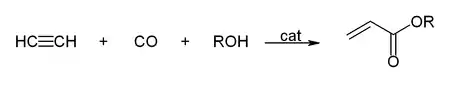
- S oxidem uhelnatým dává kyselinu akrylovou nebo akrylové estery, které lze použít pro výrobu akrylového skla.
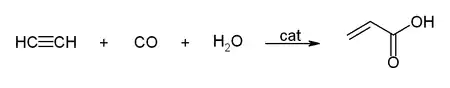
- Cyklizace dává benzen a cyklooktatetraen:
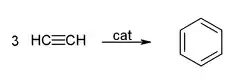
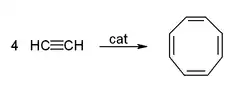
Použití

Přibližně 80 % ethynu vyrobeného ročně ve Spojených státech se využívá v chemické syntéze. Zbývajících 20 % se používá primárně pro autogenní kyslíko-acetylenové sváření a řezání kovů, díky vysoké teplotě plamene. Spalováním ethynu s kyslíkem vzniká plamen o teplotě přes 3 300 °C a uvolňuje se energie 11,8 kJ/g. Kyslíko-acetylenové autogenní svařování bylo v předchozích dekádách velmi oblíbené, avšak vývoj a výhody svařování elektrickým obloukem jej téměř nahradily.
Ethyn lze použít také v acetylenových lampách, tzv. karbidkách, využívaných dříve horníky (nezaměňovat s Davyho lampou) a v historických vozidlech, a i dnes ještě občas používané jeskyňáři. V tomto případě se ethyn vyrábí kapáním vody z horní komory lampy na pelety karbidu vápenatého (CaC2) v dolní části lampy.
V minulosti některá města využívala ethyn pro osvětlování ulic, například město Tata v Maďarsku, kde byly takové lampy instalovány 24. července 1897, nebo North Petherton v Anglii v roce 1898.
V moderní době se ethyn někdy používá k cementaci (tedy kalení povrchu) oceli, je-li předmět příliš velký na to, aby se vešel do pece.
Ethyn byl navržen jako výchozí surovina pro molekulární výrobu za použití nanotechnologií.
Ethyn se používá k uvolňování uhlíku při radiokarbonové metodě datování. Uhlíkatý materiál z archeologického vzorku reaguje s lithiem v malé specializované výzkumné peci za vzniku karbidu lithia (acetylidu lithia). Tento karbid se nechává reagovat s vodou, jako obvykle, čímž vzniká plynný ethyn, který lze zpracovat v hmotnostním spektrometru a vyhodnotit poměr izotopů uhlíku 14 a 12.
Budoucnost
Očekává se, že využití ethynu bude pokračovat ve stupňujícím se růstu, protože jsou vyvíjeny nové sféry použití. Jednou z nových aplikací je konverze na ethen (ethylen) pro výrobu různých polyethylenových plastů. V minulosti vznikalo při parním krakovacím procesu, používaném při výrobě ethenu, malé množství ethynu, které bylo odpadem. Nový katalyzátor vyvinutý ve Phillips Petroleum umožňuje většinu tohoto ethynu převést na ethen, zvýšit tak výtěžnost procesu a snížit celkové náklady.[4]
Bezpečnost a zacházení
Stlačování
Kvůli trojným vazbám mezi uhlíky je ethyn fundamentálně nestabilní a rozpadá se exotermickou reakcí, je-li příliš stlačován. Ethyn může velmi nebezpečně explodovat, pokud tlak překročí cca 200 kPa (≈39 psi), ať už jako plyn[5], kapalina nebo pevná látka. Proto se ukládá rozpuštěný v acetonu nebo dimethylformamidu (DMF) v kovové láhvi naplněné porézní látkou, jako bezpečný způsob transportu a používání. Po celém světě je transport nebezpečných tlakových lahví přísně regulován.
Při tlacích nad 100 kPa se plyn stává extrémně nestabilní a lze ho zažehnout nárazem. Při použití pro svařování a řezání je nutno řídit pracovní tlaky regulátorem, jinak se může plyn sám zapálit.
Někteří lidé byli kvůli nestabilitě ethynu zraněni při jeho explozi. Většinou k tomu došlo při neregulovaném přečerpávání plynu mezi dvěma láhvemi.
Toxické účinky
Vdechování ethynu může způsobovat závratě, bolesti hlavy a nauseu.[6] Ethyn může také obsahovat toxické nečistoty: komoditní specifikace CGA pro acetylen stanovuje systém pro identifikaci a kvantifikaci obsahu fosfanu, arsenovodíku a sulfanu v komerčním acetylenu, s cílem omezit expozici těmto nečistotám. Síra, fosfor a arsen jsou příměsmi koksu (nečisté formy uhlíku) použitého při syntéze, a lze očekávat výskyt různých organických nečistot tepelného krakování uhlovodíků.
Ethyn bývá podle literatury v poslední době občas zneužíván podobným způsobem jako oxid dusný. Takové zneužívání může vést k smrti vzhledem k toxicitě výše zmíněných nečistot (fosfanu, arsenovodíku a sulfanu). Protože je plyn pohlcen v zásobnících naplněných acetonem v pevné hmotě, určité množství acetonu s plynem odchází a také přispívá k intoxikaci. Pohnutky k tomuto chování jsou lépe pochopitelné při pohledu na anestetické vlastnosti ethynu a na adiktivní chování.
Nečistoty v ethynu lze snadno zjistit podle pachu. Čistý ethyn je bezbarvý plyn bez zápachu. Charakteristický česnekový zápach technického acetylenu je znakem kontaminace nečistotami. Mezi běžné nečistoty patří divinylsulfid, amoniak, kyslík, dusík, fosfan, arsenovodík, methan, oxid uhličitý, oxid uhelnatý, sulfan, vinylethyn, divinylethyn, diethyn, propadien, hexadien, butadienylethyn a methylethyn.
Požární rizika
Směs se vzduchem obsahující 3 až 82 % ethynu je výbušná. Minimální teplota vznícení je 335 °C.[6] Trojná vazba mezi uhlíky je slabá v porovnání s dvojnými vazbami, které vzniknou při spálení na oxid uhličitý, proto se při spalování uvolňuje extrémní množství energie.
Značení láhví
Tlakové láhve s plyny se označují barevnými pruhy pro snadnou a rychlou identifikaci, například v případě požáru. V Česku a dalších státech se používají pruhy o šířce 80 mm, umísťované pod hrdlo láhve nebo pod hrdlový kroužek. Norma ČSN EN 1089-3 zavedla nový způsob označování – od roku 2008 se ethyn (acetylen) označuje kaštanovou barvou, postaru se používala barva bílá.[7]
Jiné významy
Plurál „acetyleny“ se může někdy vztahovat ke třídě organických sloučenin známých jako alkyny, obsahujících skupinu −C≡C−.
Přirozený výskyt
Ethyn je látka ve vesmíru v menším množství běžná, často spojovaná s atmosférami plynných obrů.[8] Jedním z kuriózních objevů ethynu byl na měsíci Enceladus, patřícím k planetě Saturn. Přirozeně se vyskytující ethyn vzniká zřejmě katalytickou dekompozicí dlouhých uhlovodíkových řetězců při teplotách od 1 770 K. Protože jsou takové teploty na malých vzdálených tělesech téměř nemožné, objev potenciálně napovídá katalytickým reakcím uvnitř měsíce, což z něj činí vhodné místo pro pátrání po prebiotické chemii.[9][10]
Reference
V tomto článku byl použit překlad textu z článku Acetylene na anglické Wikipedii.
- Acetylene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Kutscheroff, M. Ber. Bunsenges. Phys. Chemie 1881, 1540–1542.
- Hydration of Acetylene: A 125th Anniversary Dmitry A. Ponomarev and Sergey M. Shevchenko Journal of Chemical Education Vol. 84 No. 10 October 2007 1725
- Acetylene: How Products are Made
- KORZUN, Mikołaj. 1000 słów o materiałach wybuchowych i wybuchu. Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej, 1986. ISBN 83-11-07044-X. OCLC 69535236
- Muir, GD (ed.) 1971, Hazards in the Chemical Laboratory, The Royal Institute of Chemistry, London.
- Požáry s přítomností tlakových láhví s acetylénem (Bojový řád jednotek požární ochrany – taktické postupy zásahu)
- Precursor to Proteins and DNA found in Stellar Disk. www.keckobservatory.org [online]. [cit. 2016-06-19]. Dostupné v archivu pořízeném dne 2016-08-09.
- Emily Lakdawalla. LPSC: Wednesday afternoon: Cassini at Enceladus [online]. The Planetary Society, 2006-03-17. Dostupné online.
- John Spencer and David Grinspoon. Planetary science: Inside Enceladus. Nature. 25 January 2007, roč. 445, s. 376–377. DOI 10.1038/445376b.
Externí odkazy
 Slovníkové heslo acetylen ve Wikislovníku
Slovníkové heslo acetylen ve Wikislovníku Encyklopedické heslo Acetylen v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Acetylen v Ottově slovníku naučném ve Wikizdrojích Obrázky, zvuky či videa k tématu Ethyn na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ethyn na Wikimedia Commons - Acetylene, the Principles of Its Generation and Use, dostupné online v projektu Gutenberg.
- (anglicky) Movie explaining acetylen formation from calcium carbide and the explosive limits forming fire hazards na YouTube
- (anglicky) Ukázka spalování acetylénu a využití pro svícení na YouTube
