Ethan
Ethan (mimo chemii dle PČP etan) je druhý nejjednodušší nasycený uhlovodík, patřící mezi alkany. Za normálních podmínek je to bezbarvý hořlavý plyn bez zápachu jen nepatrně těžší než vzduch. Ve směsi se vzduchem obsahující 3 až 12,5 % ethanu snadno exploduje.
| Ethan | |
|---|---|
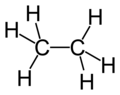
Strukturní vzorec | |

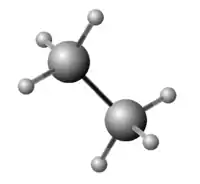
Prostorový model | |
| Obecné | |
| Systematický název | ethan |
| Sumární vzorec | C2H6 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 74-84-0 |
| EC-no (EINECS/ELINCS/NLP) | 200-814-8 |
| Indexové číslo | 601-002-00-X |
| Vlastnosti | |
| Molární hmotnost | 30,069 4 g/mol |
| Teplota tání | −183,3 °C |
| Teplota varu | −88,7 °C |
| Hustota | 0,565 g/cm³ (kap., −88,7 °C, 1 013 hPa) 2,054 kg/m³ |
| Kritická teplota Tk | 32,2 °C |
| Kritický tlak pk | 4,883 9 MPa |
| Disociační konstanta pKa | 50[zdroj?] |
| Rozpustnost ve vodě | 0,06 g/l (25 °C ) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H220 |
| R-věty | R12 |
| S-věty | S2 S9 S16 S33 |
| Teplota vznícení | 515 °C |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Průmyslově se připravuje frakčním zkapalňováním zemního plynu nebo ropných plynů.
V laboratoři jej lze připravit řadou způsobů, např. působením jodovodíku na ethanol:
případně redukcí jodethanu (ethyljodidu) zinkem ve vodném prostředí:
- CH3CH2I + Zn + H2O → CH3CH3 + Zn++ + I− + OH−
Jinou možností je syntéza Wurtzovou reakcí z jodmethanu (methyljodidu) působením zinku v bezvodém prostředí:
- 2 CH3I + Zn → CH3CH3 + ZnI2

Běžně používaným laboratorním způsobem přípravy je Kolbeho syntéza, která spočívá v elektrochemické oxidaci roztoku octanu sodného nebo draselného na anodě, přičemž v prvním stupni vzniká vysoce reaktivní radikál methyl:
- CH3COO− → CH3· + CO2 + e−
následně se pak dva tyto radikály spojí na ethan:
- 2 CH3· → CH3CH3
Vlastnosti
Geometrie molekul ethanu
Ethan je nejjednodušším alkanem, u kterého lze pozorovat různá prostorová uspořádání, související s téměř volnou otáčivostí dvou methylových skupin CH3 kolem vazby C—C mezi oběma uhlíky v molekule. Tyto různé prostorové konfigurace molekul obecně nazýváme konformace a molekulu zaujímající určitou konformaci nazýváme konformer. V závislosti na úhlu θ, zvaném torzní úhel, který svírají roviny C—C—H a H—C—C definované vodíky na sousedních uhlících, se však mění potenciální energie molekuly. Protože se vodíkové atomy vzájemně odpuzují, je potenciální energie konformeru s θ = 0° (tzv. „zákrytová“ konformace) vyšší než v případě hodnoty úhlu θ = 60° (tzv. nezákrytová konformace), a to o 12,6 kJ/mol. Proto za normální teploty většina molekul ethanu (až 99 %) bude mít konformaci blízkou hodnotám úhlu θ = 60°, 180° nebo 300° (v rozmezí ±30°), přičemž všechny tyto tři konformace budou energeticky rovnocenné. Nejstabilnější konformace má symetrii odpovídající bodové grupě D3d.
Tepelná kinetická energie molekul za normální teploty (20 °C) je 3,7 kJ/mol, tedy srovnatelně velká s energetickou bariérou, bránící volné rotaci kolem vazby C—C. Proto za těchto podmínek jeden konformer spontánně přechází v jiný, přičemž doba potřebná pro přechod (přetočení) z jedné konformace do druhé je řádově 10−11 s.
Chemické reakce ethanu
S nadbytkem vzduchu (kyslíku) se ethan spaluje na vodu a oxid uhličitý:
- 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O
Při menším množství kyslíku vzniká místo oxidu uhličitého oxid uhelnatý:
- 2 C2H6 + 5 O2 → 4 CO + 6 H2O
a při jeho nedostatku se ethan spaluje pouze na vodu a uhlík (saze):
- 2 C2H6 + 3 O2 → 4 C + 6 H2O
Citlivou oxidací může být přeměněn na kyselinu octovou:
- 2C2H6 + 3 O2 → 2CH3COOH + 2H2O
nebo na ethanol:
- 2 C2H6 + O2 → 2 C2H5OH
Zahříváním na vysokou teplotu kolem 900 °C ve směsi s vodní parou (proces zvaný hydrokrakování) se z molekuly ethanu odštěpuje vodík a vzniká nejjednodušší nenasycený uhlovodík (alken neboli olefin) ethen (ethylen):
- CH3CH3 → CH2═CH2 + H2
který je významnou chemickou surovinou. Probíhá-li obdobná reakce za přítomnosti chloru při teplotách kolem 500 °C, vzniká jiná významná surovina chlorethen (vinylchlorid):
- CH3CH3 + 2 Cl2 → CH2═CHCl + 3 HCl
Přes nevýhody této metody (silně korozivní prostředí chlorovodíku za značně vysokých teplot) je přesto průmyslově využívána.
Reakcí s chlorem vzniká směs chlorovaných derivátů, v prvním stupni pak chlorethan (ethylchlorid):
- C2H6 + Cl2 → C2H5Cl + HCl
Reakce má radikálový řetězový charakter. Je iniciována zahřátím nebo světlem (zejména ultrafialovým) a může probíhat bouřlivě až explozivně.
Reakcí s anilinem lze z ethanu připravit fenylethylamin:
C6H5NH2 + C2H6 → C6H5C2H4NH2 + H2
Fyziologické vlastnosti
Při vdechnutí má slabě narkotické účinky.
Výskyt v přírodě
Tvoří 1–6 % zemního plynu, lze ho nalézt rozpuštěný i v ropě.
Spektroskopicky byl prokázán v atmosférách velkých planet Sluneční soustavy (Jupiter, Saturn, Uran a Neptun) a v atmosféře Saturnova měsíce Titanu. Byl také objeven v komách komet.
Je též jednou z molekul nacházejících se v mezihvězdných plynových oblacích.
Využití
Ethan je významnou chemickou surovinou, která je zpracovávaná především v nalezištích zemního plynu a v petrochemických závodech, kde odpadá při zpracování ropy. Nejdůležitějšími výrobky z ethanu jsou ethen (ethylen) a chlorethen (vinylchlorid) pro výrobu plastů a kyselina octová.
Používá se také v chladírenství jako teplonosné médium.
V mikrobiologii, fyziologii a lékařství se kapalný ethan používá ke zmrazování mikroskopických vzorků, neboť jejich prudkým ochlazením se zabrání krystalizaci vody, jejíž krystalky by jinak poškodily jemnou strukturu zkoumaného materiálu.
Historie
Ethan byl poprvé syntetizován v roce 1834 Michaelem Faradayem zmíněnou elektrolytickou oxidací octanu draselného v roztoku, který však vzniklý plynný produkt omylem považoval za methan, ale dále jej již nezkoumal. V létech 1847–1849, během pokusů, které měly potvrdit radikálovou teorii organické chemie, chemici Herman Kolbe a Edward Frankland připravili ethan redukcí propionitrilu (ethylkyanidu) respektive ethyljodidu kovovým draslíkem. Kolbe jej kromě toho připravil elektrolytickou metodou stejně jako Franklin (tato metoda byla později nazvána Kolbeho jménem). Oba dva chemici považovali ethan za radikál methyl. Teprve Carl Schorlemmer v roce 1864 správně popsal chemickou povahu této látky.
Původ jména
Jméno ethan bylo odvozeno od názvu ether, původně označujícího diethylether.
Reference
- Ethane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Slovníkové heslo etan ve Wikislovníku
Slovníkové heslo etan ve Wikislovníku Encyklopedické heslo Aethan v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Aethan v Ottově slovníku naučném ve Wikizdrojích Obrázky, zvuky či videa k tématu Ethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ethan na Wikimedia Commons
