Totální syntéza cholesterolu
Totální syntéza cholesterolu je označení pro syntetické postupy vedoucí k tvorbě cholesterolu.[1] První takové syntézy popsali Robert Robinson a John Cornforth v roce 1951[2] a poté další objevili Robert Burns Woodward a Franz Sondheimer o rok později.[3] Robinsonova skupina zahájila výzkum roku 1932 a Woodwardova v roce 1949. Kolem roku 1949 bylo známo získávání steroidů, jako je kortizon, z přírodních zdrojů, což však bylo příliš nákladné.
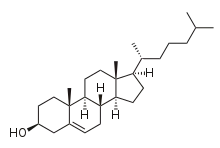
Byly dosaženy i další pokroky: v roce 1966 získal W. S. Johnson racemický cholesterol,[4] nepřirozený enantiomer cholesterolu byl popsán v letech 1996,[5] 2002[6] a 2008.[7]
Molekula
Molekula cholesterolu má tetracyklickou alkoholovou část, patří mezi steroly. Na sterolové jádro jsou navázány alkoholová skupina v poloze 3, dvojice methylových skupin na uhlících 10 a 13 a 2-isooktyl v poloze 17. Molekula má dvojnou vazbu mezi uhlíky 5 a 6, čímž se vytváří alkenová skupina. Na celé molekule se nachází 8 stereocenter.
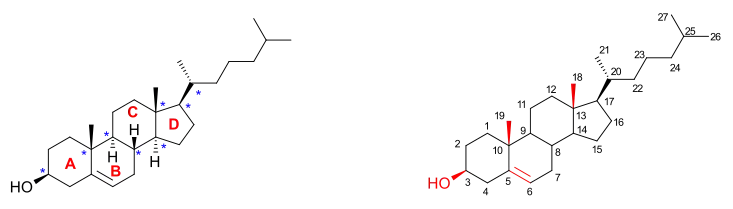
Kromě přirozených izomerů byl také připraven nepřirozený enantiomer, nazývaný ent-cholesterol.
Robinsonova syntéza
Robinsonova syntéza se vyznačuje tím, že řada jejích meziproduktů (ve všech případech jde o steroidy) jsou známy a lze je získat z přírodních zdrojů, takže bylo třeba dokázat jen to, že je možné vytvořit jedny z druhých pomocí chemické syntézy. Výchozím bodem je tu 1,6-dihydroxynaftalen 1, jenž byl v přibližně 20 krocích přeměněn na již známý androsteron 4. Dále bylo zjištěno, že androsteron lze převést na androstendion 5[8], z toho se poté povedlo dále vytvořit dehydroepiandrosteron 6, také již známou sloučeninu.[9] Z 6 vznikl pregnenolon 7 a následně allopregnanolon 8, což umožnilo navázání postranního řetězce v podobě acetátu 9 a následnu přeměnu na cholestanol 10.
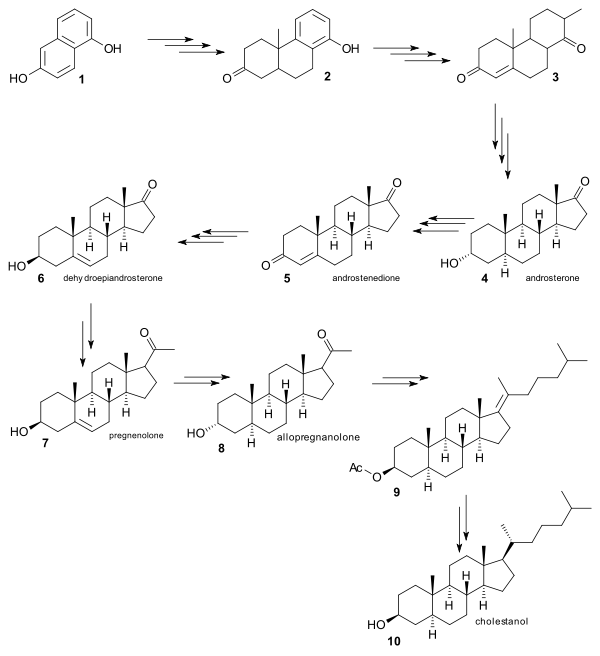
Přeměna cholestanolu na cholesterol byla provedena oxidací ketonu, bromací na bromketon a eliminací za vzniku enonu.
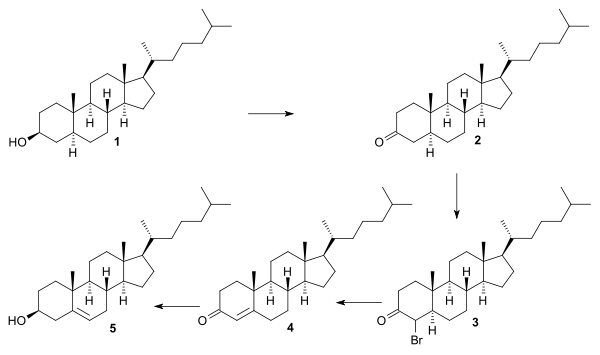
Přeměna cholestenonu na cholesterol byla provedena způsobem, který popsali William G. Dauben a Eastham v roce 1950,[10] šlo o redukci enolacetátu hydridem lithnohlinitým a frakcionací pomocí digitoninu, jež sloužila k izolaci požadovaného izomeru.
Woodwardova syntéza
Výchozí látkou Woodwardovy syntézy byl hydrochinon 1, přeměněný na cis-bicyklickou sloučeninu 2 Dielsovou–Alderovou reakcí s buta-1,3-dienem. Následné přeměny na trans-izomer 5 bylo dosaženo přípravou sodného enolátu 4 (pomocí benzenu a hydridu sodného) a následným okyselením. Redukcí hydridem lithnohlinitým poté vznikl diol 6 jenž se dehydratací kyselinou chlorovodíkovou přeměnil na ketol 7, kde pak deoxygenací jeho acetátu zinkem vznikl enon 8, ten se přeměnil na enol formylací ethylformiátem 9. Enol byl převeden na dion 11 Michaelovou adicí ethylvinylketonu (pomocí terc-butoxidu draselného a terc-butanolu), z této látky pomocí hydroxidu draselného v dioxanů vznikla tricyklická sloučenina 12, přičemž došlo k aldolové kondenzaci a odštěpení formylové skupiny. V dalším kroku oxidem osmičelým vznikl diol 13, následně ochráněný (s použitím acetonu a síranu měďnatého) jako acetonid 14, hydrogenací byl utvořen meziprodukt 15, formylací ethylformiátem enol 16, následně ochráněný jako enamin 17. S využitím (N-methylanilinu v methanolu vznikl anion 18 a pak karboxylová kyselina 19 reakcí s akrylonitrile, za přítomnosti tritonu B jako zásady.
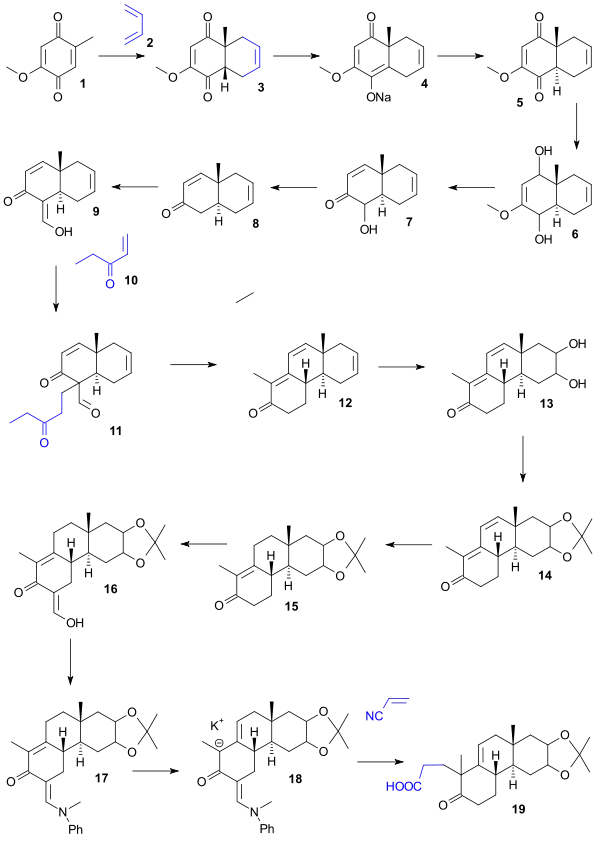
Kyselina 19 byla přeměněna na lakton 20 (pomocí acetanhydridu a octanu sodného), jehož reakcí s methylmagnesiumchloridem vznikl tetracyklický keton 21. Tento keton byl působením kyseliny jodisté (v dioxanu) a piperidinacetátu (v benzenu) převeden na aldehyd 24 přes diol 22, jenž se zoxidoval na dialdehyd 23, u něhož proběhla aldolová kondenzace. Oxidací dichromanem sodným poté vznikla karboxylová kyselina 25, následně pomocé diazomethanu změněná na methylester 26, ze kterého se působením tetrahydridoboritanu sodného vytvořil derivát allylalkoholu 27. Chirálním rouzlišením této racemické sloučeniny s využitím digitoninu se vytvořil chirální meziprodukt 28, ze kterého vznikla Oppenauerovou oxidací chirální sloučenina 29. Hydrogenací za přítomnosti Adamsova katalyzátoru vznikl alkohol 30, jenž se oxidací kyselinou chromovou změnil na keton 31. Tento keton působením tetrahydridoboritanu sodného vytvořil alkohol 32, z něhož se po hydrolýze a následné acylaci stal acetát 33, posléze chloridem thionylu přeměněný na acylchlorid 34 a methylkadmiem the ketone 35.

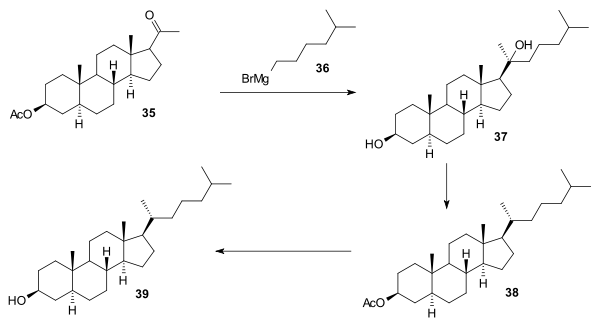
V závěrečné části reakcí 35 s isohexylmagnesiumbromidem 36 vznikl diol 37, ten byl působením kyseliny octové dehydratován a posléze hydrogenován za tvorby acetátu 38, jehož hydrolýzou se utvořil cholestanol 39. Postup přeměny cholestanolu na cholesterol byl již znám (viz Robinsonovu syntézu).
Reference
V tomto článku byl použit překlad textu z článku Cholesterol total synthesis na anglické Wikipedii.
- Robinson, Woodward and the synthesis of cholesterol Greg Mulheirn Endeavour Volume 24, Issue 3, 1 September 2000, Pages 107-110 DOI:10.1016/S0160-9327(00)01310-7
- Cardwell, H. M. E., Cornforth, J. W., Duff, S. R., Holtermann, H ,Robinson, Robert, Chemistry & Industry, 1951, 389-90
- The Total Synthesis of Steroids R. B. Woodward, Franz Sondheimer, David Taub, Karl Heusler, W. M. McLamore Journal of the American Chemical Society, 1952, 74 (17), pp. 4223–4251 DOI:10.1021/ja01137a001
- Steroid total synthesis—hydrochrysene approach—XVI: Racemic conessine, progesterone, cholesterol, and some related natural products W. S. Johnson, J. A. Marshall, J. F. W. Keana, R. W. Franck, D. G. Martin and J. V. Bauer Tetrahedron Volume 22, Supplement 8, 1966, Pages 541-601 DOI:10.1016/S0040-4020(01)90961-5
- Synthesis of ent-cholesterol, the unnatural enantiomer Scott D. Rychnovsky, Daniel E. Mickus J. Org. Chem., 1992, 57 (9), pp. 2732–2736 DOI:10.1021/jo00035a036
- Total Synthesis of ent-Cholesterol via a Steroid C,D-Ring Side-Chain Synthon" Xin Jiang and Douglas F. Covey The Journal of Organic Chemistry, 2002, 67 (14), pp. 4893–4900 DOI:10.1021/jo025535k
- A Concise Synthesis of ent-Cholesterol Scott D. Rychnovsky, Jitendra D. Belani The Journal of Organic Chemistry, 2008, 73 (7), pp. 2768–2773 DOI:10.1021/jo702694g
- Ruzicka, L., Plattner, P. A. and Aeschbacher, R. (1938), Über Steroide und Sexualhormone. 44. Mitteilung. Zur Abspaltung von Bromwasserstoff aus 2-Brom-cholestanon und 2-Brom-androstandion. Helvetica Chimica Acta, 21: 866–872 DOI:10.1002/hlca.193802101113
- Kuwada and Nakamura (1938) J. Pharm. Soc. Jpn 58, 235
- ON THE CONVERSION OF CHOLESTENONE TO CHOLESTEROL William G. Dauben, F. Jerome, J. Eastham Journal of the American Chemical Society, 1950, 72 (5), p. 2305 DOI:10.1021/ja01161a532