Stereocentrum
Stereocentrum nebo stereogenní centrum je část molekuly, nemusí nutně jít o atom, na kterou je navázáno více substituentů takovým způsobem, že výměna libovolných dvou z nich vytvoří jiný stereoizomer.[1]
Pojem stereocentrum zavedli v roce 1984 Kurt Mislow a Jay Siegel.[2]
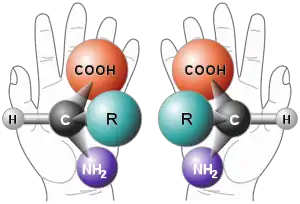
Chirální centrum nebo centrum chirality je stereocentrum obsahující substituenty (atomy nebo jejich skupiny) v takovém prostorovém uspořádání, že nemůže být ztotožněno se svým zrcadlovým obrazem. Chirální centrum je zobecněním pojmu asymetrický uhlík (což je atom uhlíku se čtyřmi různými navázanými skupinami tak, že záměna jakýchkoliv dvou skupin vede ke změně enantiomeru).[3]
V organické chemii se chirální centra obvykle vyskytují na atomech uhlíku, fosforu nebo síry, i když se, především v jiných oborech, jako jsou organokovová a anorganická chemie, mohou vyskytovat i u jiných prvků.
Možný počet stereoizomerů
Na jedné molekule se může nacházet více stereocenter a vytvářet se tak velký počet stereoizomerů. U sloučenin, kde je stereoizomerie způsobována tetraedrickými stereogenními centry, nemůže celkový počet stereoizomerů přesáhnout 2n, kde n je počet těchto stereocenter. Tato hodnota představuje horní mez, protože v důsledku souměrností je jejich počet často menší. Při dvou chirálních centrech se může vytvořit mesosloučenina, která není chirální. Některé konfigurace se nemusí vyskytovat ze sterických důvodů. Cyklické sloučeniny obsahující chirální centra nemusí být chirální, jestliže obsahují dvojčetné rotační osy. U sloučenin s rovinnou chiralitou se může objevovat chiralita, aniž by obsahovaly jediné chirální centrum.
Stereogenní centra na uhlících
Atom uhlíku, na který jsou navázány čtyři různé substituenty (atomy nebo skupiny) se označuje jako asymetrický nebo chirální uhlík.
Stereogenní centra na jiných atomech
Chiralitu mohou vyvolávat i atomy jiných prvků než uhlíku, i když u něj se vyskytují nejčastěji. Dusík a fosfor také vytvářejí vazby s tetraedrickými konfiguracemi. Dusík v aminové skupině může tvořit stereocentrum, pokud jsou všechny navázané skupiny jiné, protože má volný elektronový pár, který funguje jako čtvrtá skupina.[4]
Dusíková inverze, druh pyramidální inverze, způsobuje ovšem racemizaci, takže za běžných podmínek bývají přítomny oba epimery.[4] Racemizace prostřednictvím dusíkové inverze může být omezená (například u kvartérních amoniových a fosfoniových kationtů), nebo pomalá, která umožňuje chiralitu.[4]
Atomy kovů s tetraedrickými nebo oktaedrickými geometriemi mohou také být chirální, jestliže jsou na nich navázány navzájem odlišné ligandy. U oktaedrických geometrií může vznikat několik druhů chirality. Při třech ligandech dvou druhů mohou být ligandy uspořádány do přímky a vytvářet mer-izomer, případně na straně, kdy jde o fac-izomer. Při třech bidentátních ligandech jednoho druhu vrtulovitá struktura, kdy se jednotlivé stereoizomery označují Λ a Δ.
Odkazy
Související články
- Cahnova–Ingoldova–Prelogova pravidla - slouží k určení názvů chirálních sloučenin
Reference
V tomto článku byl použit překlad textu z článku Stereocenter na anglické Wikipedii.
- T. W. Graham Solomons; Craig Fryhle. Organic Chemistry. [s.l.]: John Wiley & Sons, 2004. Dostupné online.
- Kurt Mislow; Jay Siegel. Stereoisomerism and local chirality. Journal of the American Chemical Society. 1984, s. 3319. DOI 10.1021/ja00323a043.
- chiral (chirality) center [online]. Dostupné online.
- Janice Gorzynski Smith. Organic Chemistry. Příprava vydání Tami Hodge, Donna Nemmers, Jayne Klein. New York: McGraw-Hill, 2011. Dostupné v archivu pořízeném dne 2018-06-28. ISBN 978-0-07-337562-5. Kapitola Chapter 25 Amines, s. 949–993.