Chlorid thionylu
Chlorid thionylu je bezbarvá páchnoucí kapalina. Jeho vzorec je SOCl2, je tedy podobný vzorci fosgenu, pouze má místo uhlíku síru. Mohl by se též nazývat thionylchlorid. Jeho vzorec se dá odvodit ze vzorce kyseliny siřičité, v níž jsou obě dvě skupiny OH nahrazeny atomy chloru. Ve vodě se rozkládá na oxid siřičitý a chlorovodík. Rovnice reakce je SOCl2 + H2O → SO2 + 2 HCl.
| Chlorid thionylu | |
|---|---|
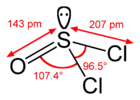
Model sloučeniny | |

Model molekuly | |
| Obecné | |
| Systematický název | Chlorid thionylu |
| Ostatní názvy | Dichlorid-oxid siřičitý |
| Anglický název | Thionyl chloride |
| Německý název | Thionylchlorid |
| Sumární vzorec | SOCl2 |
| Vzhled | Bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 7719-09-7 |
| EC-no (EINECS/ELINCS/NLP) | 231-748-8 |
| Indexové číslo | 016-015-00-0 |
| Vlastnosti | |
| Molární hmotnost | 118,972 g/mol |
| Teplota tání | −104,5 °C |
| Teplota varu | 75,6 °C |
| Hustota | 1,676 6 g/cm3 (0 °C) 1,665 g/cm3 (10 °C) 1,629 g/cm3 (25 °C) |
| Viskozita | 0,6 cP |
| Kritická teplota Tk | 294,2 °C |
| Rozpustnost v nepolárních rozpouštědlech |
Dobře rozpustný v kapalných uhlovodících |
| Relativní permitivita εr | 9,05 |
| Tlak páry | 12,88 kPa (20 °C) 19,72 kPa (30 °C) 29,50 kPa (40 °C) 61,07 kPa (60 °C) |
| Měrná magnetická susceptibilita | −5,62×10−6 cm3 g−1 |
| Struktura | |
| Tvar molekuly | Čtvercová pyramida |
| Dipólový moment | 4,8×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −247 kJ/mol |
| Entalpie varu ΔHv | 267,3 J/g |
| Entalpie rozpouštění ΔHrozp | ? |
| Standardní molární entropie S° | 278,6 JK−1mol−1 |
| Izobarické měrné teplo cp | 1,013 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H332 H302 H314 EUH014 EUH029 |
| R-věty | R14, R20/22, R29, R35 |
| S-věty | S1/2, S26, S36/37/39, S45 |
| NFPA 704 |  4
2
|
| Teplota vznícení | Není vznítitelný |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vznik chloridu thionylu
Chlorid thionylu vzniká několika způsoby:
- 1. reakce chloridu fosforečného a oxidu siřičitého:
- PCl5 + SO2 → POCl3 + SOCl2
- 2. reakce oxidu sírového a chloridu sirnatého:
- SO3 + SCl2 → SOCl2 + SO2
- 3. reakce oxidu siřičitého, chloridu sirnatého a chloru:
- SO2 + Cl2 + SCl2 → 2SOCl2
- 4. reakce oxidu sírového, chloru a chloridu sirnatého:
- SO3 + Cl2 + 2SCl2 → 3SOCl2
Reference
- Thionyl chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid thionylu na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid thionylu na Wikimedia Commons
Portály: Chemie
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.

