Hydrochinon
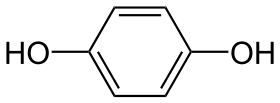
Hydrochinon (též benzen-1,4-diol, p-dihydroxybenzen nebo chinol) je aromatická sloučenina, patřící mezi fenoly, s chemickým vzorcem C6H4(OH)2. Jeho molekula obsahuje dvě hydroxylové skupiny vázané na benzenové jádro v pozici para (na protilehlých koncích). Za pokojové teploty a tlaku má hydrochinon podobu bílých granulí.
| Hydrochinon | |
|---|---|
 | |
| Obecné | |
| Systematický název | benzen-1,4-diol |
| Triviální název | hydrochinon |
| Anglický název | Hydroquinone |
| Německý název | Hydrochinon |
| Funkční vzorec | C6H4(OH)2 |
| Sumární vzorec | C3H3O |
| Identifikace | |
| Registrační číslo CAS | 123-31-9 |
| EC-no (EINECS/ELINCS/NLP) | 204-617-8 |
| Indexové číslo | 604-005-00-4 |
| PubChem | 785 |
| Vlastnosti | |
| Molární hmotnost | 110,1 g/mol |
| Teplota tání | 172 °C |
| Teplota varu | 287 °C |
| Hustota | 1,3 g/cm³ (pevné skupenství) |
| Rozpustnost ve vodě | 5,9 g/100 ml (15 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H351 H341 H302 H318 H317 H400 |
| R-věty | R22 R40 R41 R43 R50 R68 |
| S-věty | (S2) S26 S36/37/39 S61 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Nomenklatura
„Hydrochinon“ je název doporučovaný Mezinárodní unií pro čistou a užitou chemii (IUPAC) v Doporučení pro nomenklaturu organické chemie 1993.[2]
Vlastnosti
Hydrochinon může podléhat slabé oxidaci, kdy přechází na sloučeninu parabenzochinon (C6H4O2), často nazývanou p-chinon nebo jednoduše chinon. Redukce obrací tuto reakci zpět na hydrochinon. Některé biochemické sloučeniny v přírodě mají tuto část hydrochinonu nebo chinonu ve své struktuře, například Koenzym Q, a podléhají podobné redoxní přeměně.
Hydroxylové skupiny v hydrochinonu jsou slabě kyselé. Hydrochinon může ztratit H+ z jednoho z hydroxylů a vytvořit monofenolátový iont, anebo ztratit H+ z obou hydroxylů za vzniku difenolátového iontu.
Použití
Hydrochinon má různá užití principiálně spojená s jeho účinkem jakožto redukčního činidla rozpustného ve vodě. Je hlavní složkou mnoha fotografických vývojek, kde společně s metolem nebo jinými vyvíjecími látkami redukuje stříbrné halogenidy na elementární stříbro.
V humánní medicíně se hydrochinon používá k povrchové aplikaci na kůži k odstraňování zbarvení kůže, protože nemá takové predispozice ke vzniku dermatitidy jako metol. Toto použití je v některých státech zakázáno, včetně členských států Evropské unie, kde je to předmětem direktivy 76/768/EEC:1976 [3].[4]
Disodná sůl difenolátu se používá jako alternativní komonomer při výrobě polymeru PEEK.
Jakožto inhibitor polymerace hydrochinon brání polymeraci kyseliny akrylové, methylmethakrylátu apod.
Používá se také jako součást herbicidů, antioxidantů kůže a barviv.
Výskyt v přírodě
Hydrochinon je jedním ze dvou primárních reagencií v obranných žlázách brouků prskavců, společně s peroxidem vodíku (a případně dalšími chemikáliemi, v závislosti na druhu), kde se hromadí v zásobníku. Ze zásobníku se dostává přes svalově ovládaný ventil do tlustostěnné reakční komory. Tato komora je potažena buňkami, které vytvářejí katalázu a peroxidázu. Když se obsah zásobníku dostane do reakční komory, enzymy rychle rozkládají peroxid vodíku a katalyzují oxidaci hydrochinonu na chinon. Při těchto reakcích se uvolňuje volný kyslík a dost tepla na to, aby se směs přivedla k varu a zhruba pětina se vypařila, čímž obsah vystříkne z břicha brouka a vytvoří horký aerosolový oblak.
Související články
Reference
V tomto článku byl použit překlad textu z článku Hydroquinone na anglické Wikipedii.
- Hydroquinone. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Panico, R.; & Powell, W. H. (Eds.). A Guide to IUPAC Nomenclature of Organic Compounds 1993. Oxford: Blackwell Science, 1994. ISBN 0-632-03488-2.
- 76/768/EEC:1976 Council Directive 76/768/EEC of 27 July 1976 on the approximation of the laws of the Member States relating to cosmetic products : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CELEX:31976L0768:EN:HTML
- Example of a product recall in Ireland : http://www.consumerconnect.ie/eng/News_+_Research/Product_Recalls/Clear_N_Smooth_cream_withdrawn.html
Externí odkazy
 Obrázky, zvuky či videa k tématu Hydrochinon na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hydrochinon na Wikimedia Commons - International Chemical Safety Card 0166
- NIOSH Pocket Guide to Chemical Hazards
- IARC Monograph: "Hydroquinone"
- IUPAC Nomenclature of Organic Chemistry (online version of the "Blue Book")



