Kyselina jodistá
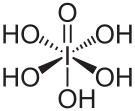
Kyselina jodistá je kyslíkatá kyselina, jejíž centrálním atomem je jód v oxidačním čísle VII. Pod označením kyselina jodistá je v chemii chápána kyselina pentahydrogenjodistá – H5IO6, tedy hydratovaná forma HIO4. Pro H5IO6 lze neformálně ale přesněji použít výraz kyselina ortojodistá, pro HIO4 pak neoficiální název kyselina metajodistá (takové označování se běžně používá v anglickém a německém jazyce). Kyselina metajodistá je kyselinou hypotetickou, existuje pouze ve formě polymeru (HIO4)n, který je nestabilní. Vzniká při tepelné dehydrataci kyseliny ortojodisté ve vakuu přes kyselinu trijodistou a nemá žádný větší praktický význam. Kyselina ortojodistá je vzhledem bílý jemně krystalický prášek. Nevykazuje žádný zápach. Je to silné oxidační činidlo, v kyselém prostředí vykazuje standardní potenciál E0=1,6 V, v zásaditém prostředí E0=0,7 V. Ve vodných roztocích (pH= 0-7) je rovnovážnou směsí volné kyseliny pentahydrogenjodisté a příslušných aniontů, jejichž poměr závisí na koncentraci a přítomnosti dalších látek a rozpouštědel. Jodistany v alkalickém prostředí existují pravděpodobně ve formě dimerního aniontu (O4I-O-IO4)4−.
| Kyselina jodistá | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Kyselina pentahydrogenjodistá |
| Anglický název | orthoperiodic acid |
| Německý název | ortho-periodsäure |
| Sumární vzorec | H5IO6 |
| Vzhled | bílé krystalky nebo prášek |
| Identifikace | |
| Registrační číslo CAS | 10450-60-9 |
| PubChem | 65185 |
| ChEBI | 29149 |
| Vlastnosti | |
| Molární hmotnost | 227,941 g/mol |
| Teplota tání | 140 °C (rozklad) |
| Hustota | 1,4 g/cm3 |
| Disociační konstanta pKa | pKa1= 3,29 (20 °C) pKa2= 6,69 (20 °C) pKa3= 13 pKa= 1,55 (HIO4, 20 °C) |
| Rozpustnost ve vodě | 113 g/100 g (0 °C) |
| Rozpustnost v polárních rozpouštědlech |
methanol ethanol |
| Měrná magnetická susceptibilita | −3,116×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −252 kJ/mol |
| Bezpečnost | |
| R-věty | R8 R34 |
| S-věty | S26 S27 S28 |
| NFPA 704 |  0
3
0
OX
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Význam
Kyselina jodistá se používá v analytické chemii jako oxidační činidlo a vzhledem k schopnosti štěpit vicinální dioly na jednotlivé fragmenty nalézá uplatnění i ve strukturní analýze složitějších organických látek a biopolymerů. V klinické chemii, mikrobiologii a histologii nalézá uplatnění jako činidlo pro důkaz bílkovin, Navíc je hlavní účinnou látkou v PAS reakci, která slouží k průkazu glykogenu ve tkáních. Značné uplatnění lze nalézt v organické syntéze.
Využití v organické syntéze
Využití kyseliny jodisté k oxidačnímu štěpení 1,2-diolů poprvé popsal Malaprade v roce 1928. Vicinální dioly se oxidačně štěpí za vzniku karbonylových sloučenin. Jsou-li hydroxylové skupiny na acyklickém řetězci vznikají dvě karbonylové sloučeniny, jsou-li součástí kruhu, vzniká jediná dikarbonylová sloučenina. U všech těchto reakcí se předpokládá vznik cyklického meziproduktu (cyklický diester kyseliny jodisté). Ke klasickým aplikacím kyseliny jodisté a jodistanů v organické syntéze patří kromě zmíněného štěpení vicinálních diolů také štěpení 1,2-hydroxyaldehydů, 1,2-hydroxyketonů, 1,2-diketonů a cyklických 1,3-diketonů. Další studie pojednávají o využití tohoto činidla k oxidační dimerizaci pyrenu, oxidacím polyaromatických uhlovodíků na chinoidní sloučeniny apod. Účinkem kyseliny jodisté byla také z pyrogallolu připravena sloučenina purpurogallin, selenidy byly převedeny na selenoxidy a thioestery na dialkylsulfoxidy.
Bezpečnost
Kyselina jodistá je klasifikována jako látka žíravá a oxidující.[1]
Odkazy
Reference
- Periodic acid – Material safety data sheet. www.indogulfgroup.com [online]. [cit. 2010-10-30]. Dostupné v archivu pořízeném dne 2012-01-27.
Literatura
- Malaprade, L. Bull. Soc. Chim. Fr. 1928,43, s. 683–696; Chem. Abstr. 1928, 22, 28855.
- McMurry, Organická chemie. 1. vyd. Brno : VUTIUM, 2007. ISBN 978-80-214-3291-8.
- Fatiadi, A. J. Synthesis 1974, s. 229–272.
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.

