Salen
Salen je označení pro tetradentátní C2 symetrický ligand získávaný reakcí salicylaldehydu (sal) s ethylendiaminem (en). Tento název se také používá pro strukturně podobné látky, hlavně pro bis-Schiffovy báze. Salen a podobné ligandy mohou vytvářet komplexy s mnoha různými kovy, čímž lze často připravit stabilní sloučeniny kovů v různých oxidačních číslech.[2] Tyto komplexy salenu s kovy nacházejí využití jako katalyzátory v organické syntéze.[3]
| Salen | |
|---|---|
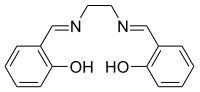
Strukturní vzorec | |
| Obecné | |
| Systematický název | 2,2'-[ethan-1,2-diylbis(nitrilomethylyliden)]difenol |
| Ostatní názvy | N,N′-ethylenbis(salicylimin) |
| Sumární vzorec | C16H16N2O2 |
| Identifikace | |
| Registrační číslo CAS | 94-93-9 |
| PubChem | 26518 |
| SMILES | C1=CC=C(C(=C1)/C=N/CC/N=C/C2=CC=CC=C2O)O |
| InChI | 1S/C16H16N2O2/c19-15-7-3-1-5-13(15)11-17-9-10-18-12-14-6-2-4-8-16(14)20/h1-8,11-12,19-20H,9-10H2/b17-11+,18-12+ |
| Vlastnosti | |
| Molární hmotnost | 268,32 g/mol |
| Teplota tání | 126 °C (399 K) |
| Bezpečnost | |
| [1] Varování[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava a vlastnosti
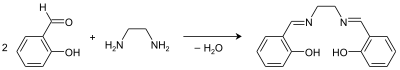
H2salen lze připravit kondenzační reakcí ethylendiaminu se salicylaldehydem.[4]

.png.webp)
Komplexy salenu s kationty kovů lze připravit, aniž by byly izolovány z reakční směsi,[5][6] a to díky vysoké stabilitě komplexu v důsledku chelatace:
Podobné ligandy
Název „salenové ligandy“ se také používá pro tetradentátní ligandy s podobnou strukturou. Příkladem může být salpn, kde je na můstek spojující atomy dusíku navázána methylová skupina; tato látka se používá jako aditivum v motorových palivech, kde zachytává kovy.
Přítomnost objemných skupin v blízkosti koordinačního centra může navyšovat katalytickou aktivitu komplexu, zabraňovat jeho dimerizaci a navyšovat rozpustnost v nepolárních rozpouštědlech jako je pentan. Tuto vlastnost mají například salenové ligandy odvozené od 3,5-di-terc-butylsalicylaldehydu. Chirální salenové ligandy lze vytvořit vhodnou substitucí diaminové skupiny, benzenových jader nebo obou těchto částí molekuly;[6] jako příklad lze uvést ligand získaný kondenzací trans-1,2-diaminocyklohexanu s 3,5-di-terc-butylsalicylaldehydem. Chirální ligandy je možné využít při asymetrické syntéze, například v Jacobsenově epoxidaci.[9]
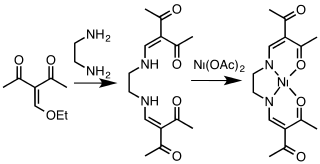
Reakcí ethylendiaminu s acetylacetonem vznikají tetradentátní ligandy s obecným označením acacen.[10] Komplexy [Co(acacen)L2]+ selektivně inhibují aktivitů proteinů obsahujících histidin skrz výměnu axiálních ligandů. Tyto látky by mohly být využity k inhibici onkogeneze.[11]
Salan a salalenové ligandy se strukturou podobají salenovým, ale mají jednu nebo dvě nasycené (aminové namísto iminových) vazby mezi dusíky a aryly. Oproti odpovídajícím salenovým ligandům mají větší elektronovou hudtotu na kovových centrech.[12][13] Salany lze připravit alkylací příslušného aminu arylhalogenidem. Existují také „polosalenové“ ligandy, ty mají pouze jednu salicyliminovou skupinu. Připravují se reakcemi salicylaldehydu s monoaminy.[14]
Jako „salenové ligandy“ nebo ligandy „salenového typu“ se označují jiné ligandy s podobnými strukturami v okolí chelačního místa, konkrétně dva kyselé hydroxyly a dvě Schiffovy báze (aryliminové skupiny). Patří sem mimo jiné salph, který vzniká kondenzací salicylaldehydu s o-fenylendiaminem a salqu, jenž se vytváří reakcí salicylaldehydu s 2-chinoxalinolem.[15]
Reference
V tomto článku byl použit překlad textu z článku Salen ligand na anglické Wikipedii.
- N,N'-Bis(salicylidene)ethylenediamine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Pier Giorgio Cozzi. Metal–Salen Schiff base complexes in catalysis: practical aspects. Chemical Society Reviews. 2004, s. 410–421.
- Subrata Shaw; James D. White. Asymmetric Catalysis Using Chiral Salen–Metal Complexes: Recent Advances. Chemical Reviews. 2019-06-11.
- T. Tsumaki. Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine. Bulletin of the Chemical Society of Japan. 1938, s. 252–260.
- Harvey Diehl; Clifford C. Hach. Bis(N,N′-Disalicylalethylenediamine)-μ-Aquodicobalt(II). Inorganic Syntheses. 1950, s. 196–201. Dostupné online. ISBN 978-0-470-13234-0.
- Pier Giorgio Cozzi. Metal-Salen Schiff base complexes in catalysis: Practical aspects. Chemical Society Reviews. 2004, s. 410–421. PMID 15354222.
- T. G. Appleton. Oxygen Uptake by a Cobalt(II) Complex. Journal of Chemical Education. 1977, s. 443.
- Shoichiro Yamada “Advancement in stereochemical aspects of Schiff base metal complexes” Coordination Chemistry Reviews 1999, volume 190–192, 537–555.
- T. P. Yoon; E. N. Jacobsen. Privileged Chiral Catalysts. Science. 2003, s. 1691–1693. PMID 12637734.
- Birgit Weber; Ernst-G. Jäger. Structure and Magnetic Properties of Iron(II/III) Complexes with N2O 2–
2 -Coordinating Schiff Base-Like Ligands. European Journal of Inorganic Chemistry. 2009, s. 455. - Elizabeth A. Bajema; Kaleigh F. Roberts; Thomas J. Meade. Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. Příprava vydání Astrid Sigel, Eva Freisinger, Roland K. O. Sigel, Peggy L. Carver. Berlin: de Gruyter GmbH, 2019. ISBN 978-3-11-052691-2. Kapitola Chapter 11. Cobalt-Schiff Base Complexes:Preclinical Research and Potential Therapeutic Uses, s. 267–301.
- David A. Atwood; Michael P. Remington; Drew Rutherford. Use of the Salan Ligands to Form Bimetallic Aluminum Complexes. Organometallics. 1996, s. 4763.
- Albrecht Berkessel; Marc Brandenburg; Eva Leitterstorf; Julia Frey; Johann Lex; Mathias Schäfer. A Practical and Versatile Access to Dihydrosalen (Salalen) Ligands: Highly Enantioselective TitaniumIn Situ Catalysts for Asymmetric Epoxidation with Aqueous Hydrogen Peroxide. Adv. Synth. Catal.. 2007, s. 2385.
- Xuan Pang, Ranlong Duan, Xiang Li, Zhiqiang Sun, Han Zhang, Xianhong Wang and Xuesi Chen (2014): "Synthesis and characterization of half-salen complexes and their application in the polymerization of lactide and ε-caprolactone" Polymer Chemistry, volume 5, issue 23, pages 6857-6864. DOI:10.1039/C4PY00734D
- Xianghong Wu; A. V. E. Gorden. 2-Quinoxalinol Salen Copper Complexes for Oxidation of Aryl Methylenes. European Journal of Organic Chemistry. 2009, s. 503–509.