Salkomin
Salkomin je komplexní sloučenina salenu s kobaltnatým kationtem. Tento rovinný komplex, stejně jako mnohé jeho deriváty, se používá jako přenašeč kyslíku a katalyzátor oxidačních reakcí v organické syntéze.[2]
| Salkomin | |
|---|---|

Strukturní vzorec | |
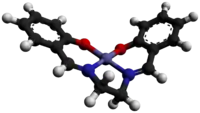
Model molekuly | |
| Obecné | |
| Systematický název | |
| Ostatní názvy | N,N′-Bis(salicyliden)ethylendiaminokobalt |
| Sumární vzorec | C16H14CoN2O2 |
| Identifikace | |
| Registrační číslo CAS | 14167-18-1 |
| PubChem | 26517 |
| SMILES | C1C[N+]2=Cc0ccccc0O[Co-2]23Oc0ccccc0C=[N+]13 |
| Vlastnosti | |
| Molární hmotnost | 325,23 g/mol |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R36/37/38 |
| S-věty | S26 S36 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava a struktura
Salkomin se připravuje reakcí octanu kobaltnatého s salenH2.[3]
Salkomin krystalizuje jako dimer. V této podobě jsou kobaltová centra pentakoordinována s fenolátovými ligandy.[4] Monomerní forma krystalizuje s chloroformem a má rovinné molekuly.[5] Salkomin působí jako Lewisova kyselina i redukční činidlo. Některé jeho solvatované deriváty na sebe vážou kyslík za vzniku komplexů typů (μ-O2)[Co(salen)py]2 a [Co(salen)py(O2)].[2]
Použití
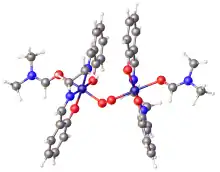
V roce 1938 bylo zjištěno, že salkomin na sebe může vratně vázat molekuly O2.[7] Tento objev vedl k rozsáhlému výzkumu a bylo nalezeno několik dalších podobných komplexů použitelných k zachycování či přenosu kyslíku. Solvatované deriváty salkominu, například adukty s chlormravenčany nebo dimethylformamidem, na sebe mohou navázat 0,5 ekvivalentů kyslíku:
- 2 Co(salen) + O2 → [Co(salen)]2O2
Salkomin katalyzuje oxidaci 2,6-disubstituovaných fenolů dikyslíkem.[8]
Reference
V tomto článku byl použit překlad textu z článku Salcomine na anglické Wikipedii.
- Salcomin. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Shoichiro Yamada “Advancement in stereochemical aspects of Schiff base metal complexes” Coordination Chemistry Reviews 1999, volume 190–192, 537–555
- T. G. Appleton. Oxygen Uptake by a Cobalt(II) Complex. Journal of Chemical Education. 1977, s. 443.
- S. Bruckner; M. Calligaris; G. Nardin; L. Randaccio. The Crystal Structure of the Form of N,N-Ethylenebis(salicylaldehydeiminato)cobalt(II) Inactive Towards Oxygenation. Acta Crystallographica Section B. 1969, s. 1671–1674.
- W. P. Schaefer; R. E. Marsh. Oxygen-Carrying Cobalt Compounds. I. Bis(salicylaldehyde)ethylenediiminecobalt(II) Monochloroformate. Acta Crystallographica Section B. 1969, s. 1675–1682.
- M. Calligaris; G. Nardin; L. Randaccio; A. Ripamonti. Structural Aspects of the Synthetic Oxygen-Carrier NN′-Ethylenebis(Salicylideneiminato)cobalt(II): Structure of the Addition Compound with Oxygen Containing Dimethylformamide. Journal of the Chemical Society A. 1970, s. 1069.
- Tokuichi Tsumaki. Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine. Bulletin of the Chemical Society of Japan. 1938, s. 252–260.
- C. R. H. I. DE JONGE, H. J. HAGEMAN, G. HOENTJEN, AND W. J. MIJS. Oxidation with Bis(Salicylidene)ethylenediiminocobalt(II) (Salcomine): 2,6-Di-''tert''-butyl-''p''-benzoquinone. Org. Synth.. 1988. Dostupné online. (anglicky); Coll. Vol.. S. 412. (anglicky)
