Hijamovo párování
Hijamovo párování je název křížové párovací reakce organosilanů s organohalogenidy, katalyzovaná palladiem, upoužívaná v&nbso;organické chemii na tvorbu vazeb uhlík–uhlík (C-C). Objevili ji Tamedžiro Hijama a Jasuo Hatanaka v roce 1988 jako způsob chemo- a regioselektivní tvorby těchto vazeb.[1]
Hijamovo párování bylo zapojeno do syntéz mnoha různých přírodních látek.[2]
Historie
Hijamovo párování bylo vyvinuto za účelem překonat obtíže spojené s jinými organokovovými reaktanty. Původně reakce organokřemičitých sloučenin popsal M. Kumada, konkrétně šlo o reakci, v níž byly použity organofluorokřemičitany.[3]
Následně Hijama objevil organosilany a po aktivaci zdroje fluoridových iontů proběhla reakce.[4][5]
Tato reaktivita v kombinaci se solemi palladia vytváří vazby C-C na elektrofilním uhlíku. Ve srovnání s jinými organokovovými sloučeninami, jako jsou organohořečnaté (Grignardova činidla) a organomědné reaktanty, jež jsou značně reaktivní a mají nízkou chemoselektivitu a mohou tak zničit funkční skupiny na obou párovaných sloučeninách, jsou organokřemičité sloučeniny neaktivní. Činidla využívající kovy a polokovy, jako jsou zinek, cín a bor, mají nižší reaktivitu, objevují se u nich ovšem jiné potíže. Organozinečnatá činidla jsou citlivá na vlhkost, organocínové sloučeniny jsou toxické a organoboritá vykazují špatnou dostupnost, jsou nákladné a často nestálé. Organosilany mají dobrou dostupnost, po aktivaci (podobně jako u organocínových a organoboritých sloučenin) fluoridem nebo zásadou mohou reagovat s organohalogenidy za chemoselektivního i regioselektivního vzniku vazeb C-C. Nejprve byla popsána párování snadno vytvořitelných (a aktivovatelných) organokřemičitých nukleofilů a organohalogenidových elektrofilů za přítomnosti palladiových katalyzátorů.[1] Od tohoto objevu bylo využití reakce rozšířeno na další skupiny a vyřešeny byly problémy související s prvními variantami, jako je potřeba aktivace organosilanu fluoridem.

Mechanismus
Organosilan je aktivován fluoridem (solí jako je tetra-n-butylmmoniumfluorid (TBAF) nebo TASF) či zásadou, čímž vzniká pětivazné křemíkové centrum, jež je dostatečně nestálé, aby došlo k rozštěpení vazby C-Si během transmetalačního kroku.[6] Níže je zobrazeno obecné schéma tvorby tohoto meziproduktu. Tento krok probíhá současně s katalytickým cyklem.
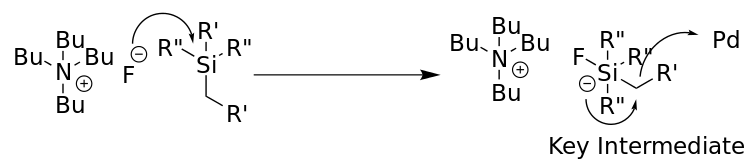
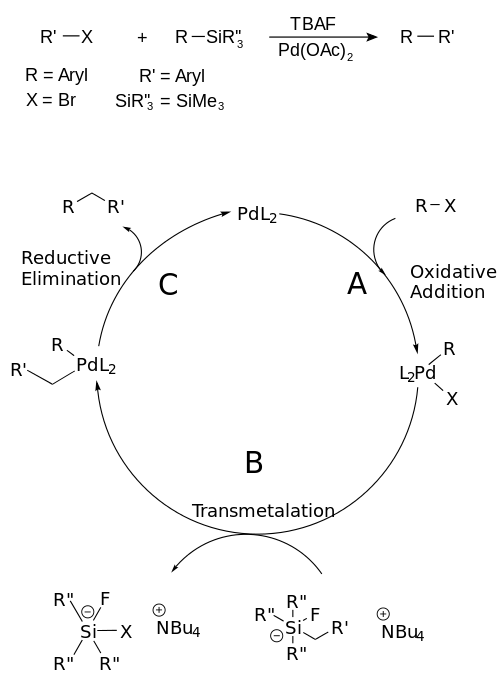
Mechanismus Hijamova párování zahrnuje katalytický cyklus, skládající se z těchto částí: A) oxidační adice, kde se organohalogenid naváže na palladium a zoxiduje jej z Pd0 na Pd2; B) transmetalace, při níž zaniká vazba C-Si a druhý uhlíkatý fragment se naváže na palladium; a C), což je redukční eliminace, kde se utvoří vazba C- a palladium je zredukováno zpět na Pd0, čímž dojde k obnově katalyzátoru.[7]
Katalytický cyklu je zobrazen na tomto obrázku:
Rozsah a omezení
Rozsah
Hijamovo párování může být použito na tvorbu vazeb Csp2-Csp2 (například aryl–aryl) i Csp2-Csp3 (například aryl–alkyl). Dobré výtěžnosti byly získány při párování arylhalogenidů, vinylhalogenidů a allylhalogenidů; nejlepší se objevovaly při použití organojodidů. Scott E. Denmark rozšířil možnosti reakce na uzavírání středně velkých kruhů.[8]
Párování alkylhalogenidů lze provést s organohalosilany namísto organosilanů. Organochlorsilany se mohou párovat s arylchloridy, které jsou obecně levnější než aryljodidy.[9]
S katalyzátory založenými na niklu je možné provést nové druhy reakcí organotrifluorsilanů.[10]
Sekundární alkylhalogenidy reagují s arylsilany[11] při vysokých výtěžnostech.

Omezení
Hijamovo párování je omezeno nutností aktivovat organokřemičité činidlo pomocí fluoridu. Přidání fluoridu rozštěpí všechny chránicí skupiny ochraňující křemík, jako jsou silylethery,[12]) v organické syntéze poměrně často používané. Fluoridový ion je také zásaditý, a tak může mít vliv na citlivé chránicí skupiny, kyselé protony i různé funkční skupiny. Většina výzkumu této reakce se zaměřuje na vypořádání se s těmito potížemi; za tímto účelem byla vyzkoušena řada různých skupin, zásaditých aktivátorů i organosilanů, čímž vzniklo několik variant Hijamova párování.
Varianty
Jedna z obměn Hijamova párování využívá silacyklobutanový kruh a hydratovaný zdroj fluoridu.[13]
Tento postup je založený na alkoxysilanech a organosilanolech namísto alkylsilanů. Mechanismus této reakce, využívající zdroj fluoridu, umožnil vývoj dalších variant bez použití zdroje fluoridu.

Bezfluoridové Hijamovy reakce
Bylo vyvinuto několik obměn Hijamova párování, které nevyžadují aktivaci fluoridu. S využitím organochlorsilanů je možné provést párování s hydroxidem sodným (NaOH) jako zásaditým aktivátorem.[14]
Byly popsány obměny používající alkoxysilany s mírnějšími zásadami, jako je NaOH,[15] či dokonce voda.[16]
Studium těchto mechanismů vedlo k rozvoji Hijamových–Denmarkových reakcí, ve kterých se používají organosilanoly.

Další skupinu bezfluoridových Hijamových reakcí představují ty, do kterých se zapojují Lewisovy kyseliny se zásadami, jako jsou fosforečnan draselný (K3PO4),[17] či reakce prováděné bez přítomnosti zásad.[18][19]
Přidáním měděného katalyzátoru lze rovněž umožnit použití mírnějšího aktivačního činidla[17], dokonce je možné provést reakce, v nichž se vyskytují PdII a CuI, i bez stechiometrických množství Lewisových kyselin (například stříbrných,[18] či měďných solí[19]).
Hijamovo–Denmarkovo párování
Hijamovo–Denmarkovo párování je obměněná podoba Hijamova párování, která pro aktivaci organosilanolů a organohalogenidů nevyžaduje přítomnost fluoridů. Níže je zobrazen obecný průběh reakce, jenž znázorňuje využití Brønstedovy zásady jako aktivačního činidla; na kovové centrum jsou navázány fosfinové ligandy.[2]
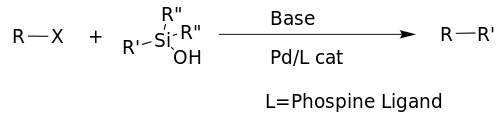
Na následujícím obrázku je vyobrazen příklad této reakce. Při použití fluoridu by terc-butyldimethylsilylether pravděpodobně byl zničen.[20]
.png.webp)
Mechanismus
Zkoumáním mechanismu Hijamovy–Denmarkovy párovací reakce bylo zjištěno, že tvorba silonátu dostačuje k aktivaci adice organosilanu na palladiové centrum. Přítomnost pětivazného křemíku není nutná a závislost rychlosti reakce na koncentraci silonátu odpovídá prvního řádu.[2] protože při tvorbě vazby Pd-O, která má podstatný význam pro transmetalační krok, se tím umožňuje přesun uhlíkatého fragmentu na palladiové centrum. Na základě těchto pozorování se předpokládá, že krokem určujícím rychlost reakce je zde tvorba vazby Pd-O, kde zvýšení koncentrace silonátu reakci urychluje.


Odkazy
Související články
- Heckova reakce
- Kumadovo párování
- Negišiovo párování
- Sonogaširova reakce
- Stilleova reakce
- Suzukiova reakce
- Křížová párovací reakce
Reference
V tomto článku byl použit překlad textu z článku Hiyama coupling na anglické Wikipedii.
- Y. Hatanaka; T. Hiyama. Cross-coupling of organosilanes with organic halides mediated by a palladium catalyst and tris(diethylamino)sulfonium difluorotrimethylsilicate. The Journal of Organic Chemistry. 1988, s. 918–920. DOI 10.1021/jo00239a056.
- S. E. Denmark; C. S. Regens. Palladium-Catalyzed Cross-Coupling Reactions of Organosilanols and Their Salts: Practical Alternatives to Boron- and Tin-Based Methods. Accounts of Chemical Research. 2008, s. 1486–1499. DOI 10.1021/ar800037p. PMID 18681465.
- J. Yoshida; K. Tamao; H. Yamamoto; T. Kakui; T. Uchida; M. Kumada. Organofluorosilicates in organic synthesis. 14. Carbon-carbon bond formation promoted by palladium salts. Organometallics. 1982, s. 542–549. DOI 10.1021/om00063a025.
- T. Hiyama; M. Obayashi; I. Mori; H. Nozaki. Generation of metal-free silyl anions from disilanes and fluoride catalyst. Synthetic reactions with aldehydes and 1,3-dienes. The Journal of Organic Chemistry. 1983, s. 912–914. DOI 10.1021/jo00154a043.
- M. Fujita; T. Hiyama. Erythro-directive reduction of .alpha.-substituted alkanones by means of hydrosilanes in acidic media. The Journal of Organic Chemistry. 1988, s. 5415–5421. DOI 10.1021/jo00258a004.
- T. Hiyama. How I came across the silicon-based cross-coupling reaction. Journal of Organometallic Chemistry. 2002, s. 58–61. DOI 10.1016/s0022-328x(02)01157-9.
- N. Miyaura; A. Suzuki. Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds. Chemical Reviews. 1995, s. 2457–2483. DOI 10.1021/cr00039a007.
- S. E. Denmark; S.-M. Yang. Intramolecular Silicon-Assisted Cross-Coupling Reactions: General Synthesis of Medium-Sized Rings Containing a 1,3-cis-cis Diene Unit. Journal of the American Chemical Society. 2002, s. 2102–2103. DOI 10.1021/ja0178158. PMID 11878949.
- K.-i. Gouda; E. Hagiwara; Y. Hatanaka; T. Hiyama. Cross-Coupling Reactions of Aryl Chlorides with Organochlorosilanes: Highly Effective Methods for Arylation or Alkenylation of Aryl Chlorides. The Journal of Organic Chemistry. 1996, s. 7232–7233. DOI 10.1021/jo9611172. PMID 11667637.
- D. A. Powell; G. C. Fu. Nickel-Catalyzed Cross-Couplings of Organosilicon Reagents with Unactivated Secondary Alkyl Bromides. Journal of the American Chemical Society. 2004, s. 7788–7789. DOI 10.1021/jo9611172. PMID 10.1021/ja047433c.
- N. A. Strotman; S. Sommer; G. C. Fu. Hiyama Reactions of Activated and Unactivated Secondary Alkyl Halides Catalyzed by a Nickel/Norephedrine Complex. Angewandte Chemie International Edition. 2007, s. 3556–3558. DOI 10.1002/anie.200700440. PMID 17444579.
- Greene, T. W.; Wuts, P. G. M. Protective Groups In Organic Synthesis, 3rd ed.; John Wiley & Sons: New York, 1991. ISBN 0471160199
- S. E. Denmark; D. Wehrli; J. Y. Choi. Convergence of Mechanistic Pathways in the Palladium(0)-Catalyzed Cross-Coupling of Alkenylsilacyclobutanes and Alkenylsilanols. Organic Letters. 2000, s. 2491–2494. DOI 10.1021/ol006170y. PMID 10956529.
- E. Hagiwara; K.-i. Gouda; Y. Hatanaka; T. Hiyama. NaOH-Promoted cross-coupling reactions of organosilicon compounds with organic halides: Practical routes to biaryls, alkenylarenes and conjugated dienes. Tetrahedron Letters. 1997, s. 439–442. DOI 10.1016/s0040-4039(96)02320-9.
- S. Shi; Y. Zhang. Pd(OAc)2-Catalyzed Fluoride-Free Cross-Coupling Reactions of Arylsiloxanes with Aryl Bromides in Aqueous Medium. The Journal of Organic Chemistry. 2007, s. 5927–5930. DOI 10.1021/jo070855v. PMID 17585827.
- C. Wolf; R. Lerebours. Palladium−Phosphinous Acid-Catalyzed NaOH-Promoted Cross-Coupling Reactions of Arylsiloxanes with Aryl Chlorides and Bromides in Water. Organic Letters. 2004, s. 1147–1150. DOI 10.1021/ol049851s. PMID 15040744.
- Y. Nakao; M. Takeda; T. Matsumoto; T. Hiyama. Cross-Coupling Reactions through the Intramolecular Activation of Alkyl(triorgano)silanes. Angewandte Chemie. 2010, s. 4549–4552. DOI 10.1002/ange.201000816.
- K. Hirabayashi; A. Mori; J. Kawashima; M. Suguro; Y. Nishihara; T. Hiyama. Palladium-Catalyzed Cross-Coupling of Silanols, Silanediols, and Silanetriols Promoted by Silver(I) Oxide. The Journal of Organic Chemistry. 2000, s. 5342–5349. DOI 10.1021/jo000679p. PMID 10993364.
- Y. Nishihara; K. Ikegashira; K. Hirabayashi; J.-i. Ando; A. Mori; T. Hiyama. Coupling Reactions of Alkynylsilanes Mediated by a Cu(I) Salt: Novel Syntheses of Conjugate Diynes and Disubstituted Ethynes. The Journal of Organic Chemistry. 2000, s. 1780–1787. DOI 10.1021/jo991686k. PMID 10814151.
- S. E. Denmark; R. C. Smith; W.-T. T. Chang; J. M. Muhuhi. Cross-Coupling Reactions of Aromatic and Heteroaromatic Silanolates with Aromatic and Heteroaromatic Halides. Journal of the American Chemical Society. 2009, s. 3104–3118. DOI 10.1021/ja8091449. PMID 19199785.