Triflát
Triflát, známý také pod systematickým názvem trifluormethansulfonát, je funkční skupina se vzorcem CF3SO2O–. Někdy se uvádí zkráceně −OTf, například butyltriflát lze zapsat CH3CH2CH2CH2OTf.

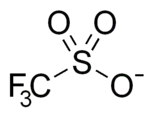
Odpovídající triflátový aniont CF3SO −
3 je značně stabilní, jedná se o konjugovanou bázi kyseliny trifluormethansulfonové, jedné z nejsilnějších známých kyselin, která patří mezi superkyseliny, jelikož je silnější než čistá kyselina sírová.
Použití a vlastnosti
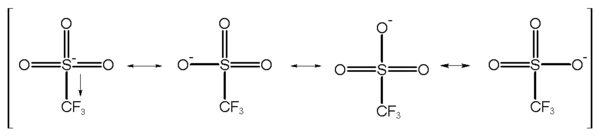
Triflátová skupina se využívá v některých organických reakcích jako je nukleofilní substituce. Jelikož alkyltrifláty velmi snadno podléhají SN2 reakcím, musejí být skladovány za nepřítomnosti nukleofilů (jako je například voda). Anion se stabilizuje díky vzniku rezonančních struktur, což způsobí, že se záporný náboj rozšíří na tři kyslíkové atomy a na atom síry.
Triflát se také používá jako ligand pro lanthanoidy a kovy 11. skupiny a 13. skupiny.
V některých lithium-iontových akumulátorech se používají trifláty lithia jako složky elektrolytu.
Triflátové soli
Triflátové soli jsou v bezvodé formě velmi stabilní, dají se získat přímo z kyseliny trifluormethansulfonové a vodného roztoku příslušného hydroxidu, uhličitanu či chloridu.
Teplota tání sodných, draselných a boritých solí je přes 350 °C
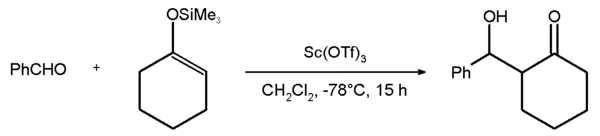
Kovové trifláty se používají v organické chemii jako Lewisovy kyseliny, příklady mohou být trifláty lanthanoidů (obecně Ln(OTf)3) nebo triflát skanditý používaný v reakcích jako jsou aldolové a Dielsovy–Alderovy reakce. Příkladem může být Mukaiyamova aldolová adice benzaldehydu se silylenoletherem cyklohexanolu, jejíž výtěžnost je 81 %.[1]:
Odpovídající reakce s yttritou solí neprobíhá.
Triflát je často používaným protiiontem u organokovových komplexů.
Reference
V tomto článku byl použit překlad textu z článku Triflate na anglické Wikipedii.
- Kobayashi, S. Scandium Triflate in Organic Synthesis. European Journal of Organic Chemistry. S. 15–27. DOI 10.1002/(SICI)1099-0690(199901)1999:1<15::AID-EJOC15>3.0.CO;2-B. (anglicky)